
科目: 来源: 题型:
【题目】利用活性铁可以很好地消除酸性水体中NO3-造成的污染,除去原理如图所示。下列说法中正确的是
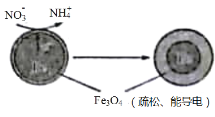
A.铁电极的电极反应式:3Fe-8e-+4H2O=Fe3O4+8H+
B.NO3-在负极上发生还原反应
C.除NO3-的过程中水体pH减小
D.当电路中有4 mol电子转移时,溶液中会有1 mol NH4+生成
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。下列说法错误的是

A.④中a导管应向下延伸至接近瓶底
B.若撤去⑥,则⑤中可能有Fe2O3生成
C.当⑤中充满黄绿色气体时再点燃⑤处酒精灯
D.③中试纸若是湿润的,则根据产生的现象可证明氯气有酸性,漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】李兰娟院士团队在救治感染新型冠状病毒患者过程中,发现达芦那韦对新冠病毒有一定的抑制作用。下列有关该物质的说法正确的是
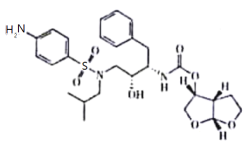
A.含有苯环,属于芳香烃
B.苯环上的一溴代物代物有5种同分异构体
C.1 mol该物质最多能与7 mol H2发生加成反应
D.不能溶于水、酸溶液、碱溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
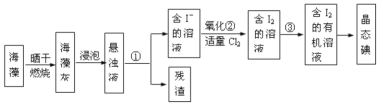
(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有______
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(3)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(4)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法错误的是
A.3.6 g C60与C50组成的混合物中。含有的电子数目为1.8NA
B.6.72 L(标准状况)Cl2与足量乙烷反应时,断裂的C-H键数目为0.3NA
C.0.1 L浓度均为2 mol/L的(NH4)2SO4、NH4Cl溶液中,NH4+数目前者比后者多0.2 NA
D.0.1 mol H3BO3[电离方程式:H3BO3+H2O![]() H++B(OH)4-]消耗OH-数目最多为0.1 NA
H++B(OH)4-]消耗OH-数目最多为0.1 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶炼铝的原料,其工艺流程如下图所示:
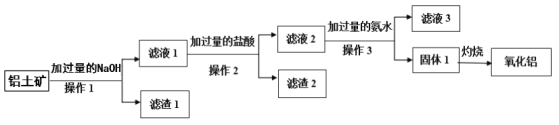
请回答下列问题。
(1)操作1、2、3的名称均为__________。
(2)滤液1中所含的阴离子除OH-外,还有________、_______(填离子符号),滤渣2 的成份为_________(填化学式)。
(3)滤液2中加入过量氨水生成固体1的离子反应方程式为_________。
(4)滤液3中溶质的主要成份属于盐类的物质是_______、________(填化学式)。
(5)固体1灼烧发生反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中药麻黄成分中含有生物碱、黄酮、鞣质、挥发油、有机酚、多糖等许多成分,其中一种有机酚的结构简式如图。下列说法正确的是 ( )
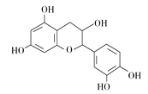
A. 分子中所有碳原子可以处于同一平面
B. 分子式为C15H12O7
C. 1 mol该有机物跟足量浓溴水反应,最多消耗5 mol Br2
D. 1 mol该有机物与NaOH溶液反应最多消耗5 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
A. 接近称量质量时,轻振手腕,加够药品
B. 溶解时,用量筒控制所加蒸馏水的量
C. 移液时,玻璃棒插在刻度线上,防止液体洒出![]()
D. 接近刻度线1~2cm时,用胶头滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
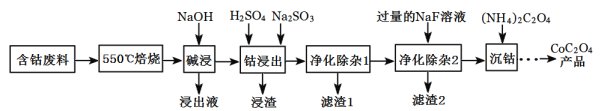
(1)“550℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃加入H2O2溶液,其目的是______。(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是______。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol/L,则滤液中c(Mg2+)为___[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.000g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂,它们的一些性质及制备方法如下所示:
Ⅰ.氯化铁:熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。工业上采用向500~600 ℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670 ℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用如图所示的装置模拟工业生产无水氯化铁,请回答相关问题:
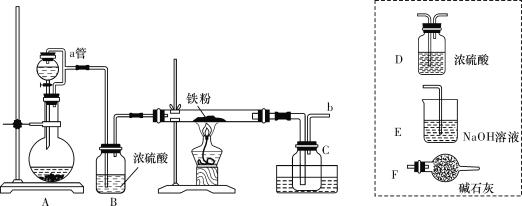
(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为_______。
(2)导管b口应与_______(从虚线框内装置中选择装置后用字母代号填空)连接,这样可避免反应系统与环境间的相互影响。
(3)实验完成后,取广口瓶C中收集到的产物进行如下测定①称取4.52 g样品溶于过量的稀盐酸中;②加入足量H2O2;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40 g。则该样品中铁元素的质量分数为___________%(结果精确到小数点后两位)。
(4)由以上数据分析和计算得出结论:
①用此装置制得的无水氯化铁含铁量______(填“偏高”或“偏低”),显然其中含有较多的__________(填化学式)杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com