
科目: 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
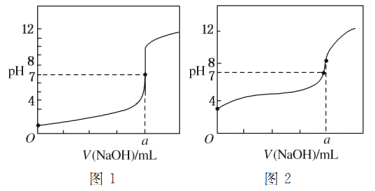
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
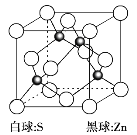
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种重要的工业原料和清洁能源,可用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等。
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH= _______kJ·mol1。
CO2(g)+4H2(g) ΔH= _______kJ·mol1。
(2)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。
2NH3(g) ΔH=92.4 kJ·mol1。
①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有_______(填字母代号)。
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K__________(填“增大”“不变”或“减小”)。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L1·min1,H2的平衡转化率为_______(保留三位有效数字),则该温度下反应的平衡常数K=_______。
(3)下图所示装置工作时均与H2有关。
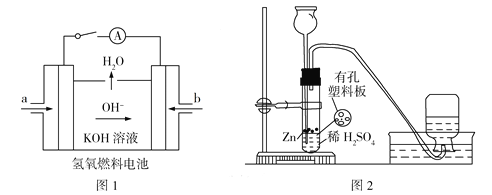
①图l所示装置,通入H2的管口是______(填字母),正极反应式为___________________。
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是_____________________,若反应装置中硫酸过量,则加入CuSO4溶液后,生成的氢气量__________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如图:
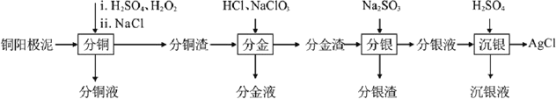
已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
ⅲ“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率/% | 85.7 | 0 | 4.5 | 93.5 |
(1)由表中数据可知,Ni的金属性比Cu____。分铜渣中银元素的存在形式为_________(用化学用语表示)。
(2)“分金”时,单质金发生反应的离子方程式为____。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。
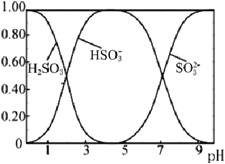
“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为__。调节溶液的pH不能过低,理由为__(用离子方程式表示)。
(4)工业上,用镍为阳极,电解0.1mol/LNiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
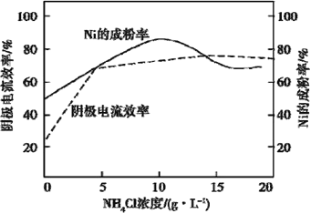
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_____g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
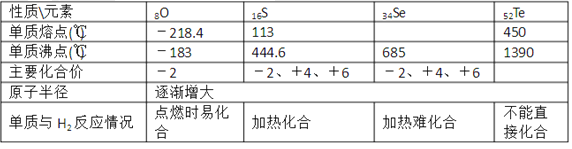
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
科目: 来源: 题型:
【题目】B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Fe2+的电子排布式为_____;Ti原子核外共有________种运动状态不同的电子。
(2)BH3分子与NH3分子的空间结构分别为_________;BH3与NH3反应生成的BH3·NH3分子中含有的化学键类型有_______,在BH3·NH3中B原子的杂化方式为________。
(3)N和P同主族。科学家目前合成了N4分子,该分子中N—N—N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途___________。(写出一种即可)
(4)NH3与Cu2+可形成[Cu(NH3)4]2+配离子。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是____。
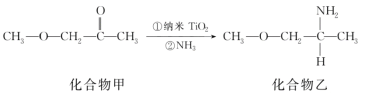
(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲,主要原因是______。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可降解聚合物 P 的合成路线如图:
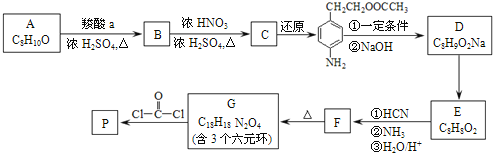
已知: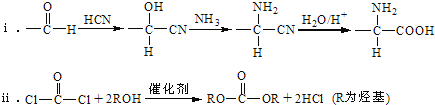 .
.
(1)A的含氧官能团名称是______。
(2)羧酸a的电离方程式是______。
(3)B→C的化学方程式是______。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是______。
(5)E→F中反应①和②的反应类型分别是______、______。
(6)F的结构简式是______。
(7)G→聚合物P的化学方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在25℃、101kPa时,H2与O2化合生成1molH2O(g)放出241.8kJ的热量,其热化学方程式为______.
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJ/mol
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g)△H=______kJ/mol.
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
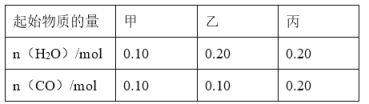
①该反应的平衡常数表达式为______.
②平衡时,甲容器中CO的转化率是______;容器中CO的转化率:乙______甲;丙______甲.(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度______(填“升高”或“降低”).
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
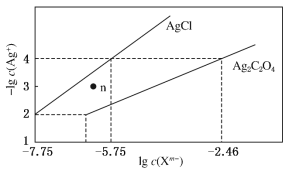
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X、Y、Z、W、M、N原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物YW2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置________周期________族,X、Y、Z、W、M的原子半径由大到小的顺序为____________________________________(用元素符号表示)。
(2)写出YW2的电子式________;Z2X4结构式________________________________。
(3)X、Z、W形成的化合物,可用作化肥的盐是________,该物质所含化学键的类型是________。
(4)均由X、W、M、N四种元素组成的两种化合物相互反应,有刺激性气味气体放出,反应的离子方程式为____________________________________________________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的化学方程式________________________________________________________________________。
(6)写出NW2通入硝酸钡溶液中的离子方程式_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com