
科目: 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
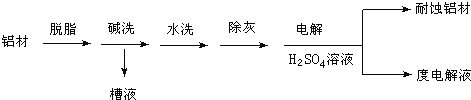
碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中的铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的____。
a.NH3 b.CO2 c.NaOH d.HNO3
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是________。
(3)利用下图装置,可以模拟铁的电化学防护。
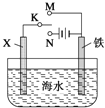
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物
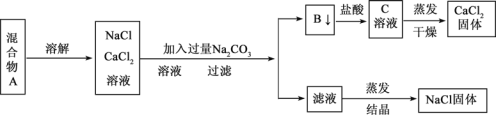
回答下列问题
(1)方案中反应的离子方程式是 __________、________________。
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一设计有毛病,这一步的正确设计方案应是____________________________。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B 物质和另一物质的质量,这种物质是__________________。(填物质对应的字母)
(4)实验过程中检验洗涤 B 物质是否洗净的方法是___________________。
(5)该实验过程中需要0.1mol/L的Na2CO3溶液450 mL,实验老师用碳酸钠晶体(Na2CO3·10H2O)配制该浓度的溶液。请你协助老师完成下列问题:
① 配制Na2CO3溶液时需要的主要玻璃仪器有烧杯、玻璃棒、___________________。
② 该实验的第一步是计算,称取_________g碳酸钠晶体。
③ 若定容时仰视刻度线,则所配制的溶液浓度_____________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:______________________。
(2)H3PO2及NaH2PO2均可将AgNO3溶液中的Ag+ 还原为银,从而可用于化学镀银。
①H3PO2中,磷元素的化合价为______。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出该反应的化学方程式,并在方程式中用单线桥表示该反应的电子转移:_______。
③NaH2PO2为____________ (填“正盐”或“酸式盐”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用中和滴定法测定烧碱纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______________________。
(2)取10.00 mL待测液,用_____________式滴定管量取。
(3)用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视_____________,直到滴定终点。
(4)根据下列数据,烧碱的纯度为_____________(以百分数表示,小数点后保留两位)。
滴定次数 | 待测体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准的盐酸滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视_____________;
②用待测液润洗锥形瓶_____________;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】相对分子质量为M的气态化合物V L(标准状况),溶于m g 水中(不与水反应),得到质量分数为w%的溶液,物质的量浓度为cmol/L,密度为ρ g·cm-3,则下列说法正确的是
A. 溶液密度ρ= ![]() B. 相对分子质量M=
B. 相对分子质量M=![]()
C. 物质的量浓度c=![]() D. 溶质的质量分数w%=
D. 溶质的质量分数w%=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴(8分)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则

①电解池中X极上的电极反应式是 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式是 ,
检验该电极反应产物的方法是 。
⑵(6分)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是
②Y电极的材料是 ,电极反应式是
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目: 来源: 题型:
【题目】V mL Al2(SO4)3溶液中含有Al3+ a g,取0.5V mL溶液稀释到8V mL,则稀释后溶液中SO42-的物质的量浓度是
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
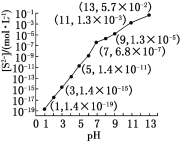
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是
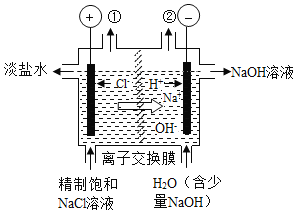
A. 装置出口①处的物质是氯气
B. 出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C. 装置中发生的反应的离子方程式2Cl﹣+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D. 该装置是将电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com