
【题目】用中和滴定法测定烧碱纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______________________。
(2)取10.00 mL待测液,用_____________式滴定管量取。
(3)用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视_____________,直到滴定终点。
(4)根据下列数据,烧碱的纯度为_____________(以百分数表示,小数点后保留两位)。
滴定次数 | 待测体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准的盐酸滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视_____________;
②用待测液润洗锥形瓶_____________;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁__________________________。
【答案】250 mL容量瓶、胶头滴管、天平 碱 锥形瓶内溶液颜色变化 93.02% 偏小 偏大 无影响
【解析】
(1)依据一定体积物质的量浓度溶液配制时的操作步骤所需的仪器作答;
(2)待测液为氢氧化钠,显碱性;
(3)依据正确的操作步骤作答;
(4)先计算出标准盐酸的体积,依据 c(测) = 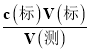 ,最后计算出烧碱的质量,得出纯度;
,最后计算出烧碱的质量,得出纯度;
(5)依据操作不当对标准溶液体积的影响判断误差,结合c(测) = 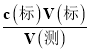 来分析对测定结果的影响;
来分析对测定结果的影响;
(1)配成250mL的待测液,需要的仪器除小烧杯、量筒、玻璃棒外,还有250mL容量瓶,胶头滴管、天平等;
(2)氢氧化钠溶液显碱性,所以取10.00mL待测液,应该用碱式滴定管来量取,故答案为:碱;
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手控制活塞,右手不停地振荡锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点,故答案为:锥形瓶内溶液颜色变化;
(4)根据表中数据可知,两次实验中消耗盐酸的体积是20.40 mL -0.50 mL =19.90mL、24.10 mL -4.00 mL =20.10mL,则消耗盐酸体积的平均值是![]() =20.00 mL,则待测烧碱溶液的浓度是
=20.00 mL,则待测烧碱溶液的浓度是![]() =0.4000mol/L,故样品中m(NaOH)=0.4000mol/L×0.250L×40g/mol=4.0g,则烧碱的纯度为:
=0.4000mol/L,故样品中m(NaOH)=0.4000mol/L×0.250L×40g/mol=4.0g,则烧碱的纯度为:![]() ×100%=93.02%;
×100%=93.02%;
(5)①读数:滴定前平视,滴定后俯视,会导致标准溶液的体积偏小,最后使测定的氢氧化钠的浓度偏小,导致最终结果偏小;
②用待测液润洗锥形瓶,会使待测液浓度偏大,消耗的标准液的体积偏大,最后使测定的氢氧化钠的浓度偏大,导致最终结果偏大;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁,对待测液的物质的量无影响,测定的浓度无影响,因此最后对最终结果也无影响。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )

A. 分子式为C8H16B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体D. 一氯代物有4种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
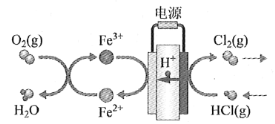
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A. HCO3的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 泡沫灭火器的原理:Al3++3HCO3- ![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C. NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
D. Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,其相对分子质量为104,碳的质量分数为92.3%。
(1)芳香烃A的分子式为_________,其名称为_____________。
(2)A可与溴的四氯化碳溶液反应,其化学方程式为____________________,该反应类型为_______。
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式____________。
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中说法不正确的是( )
A.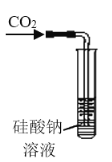 可用来证明碳的非金属性比硅强
可用来证明碳的非金属性比硅强
B.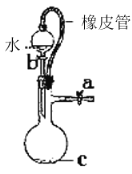 橡皮管的作用是能使水顺利流下
橡皮管的作用是能使水顺利流下
C. 用图示的方法不能检查此装置的气密性
用图示的方法不能检查此装置的气密性
D. 先从①口进气集满CO2,再从②口进气,可收集NO
先从①口进气集满CO2,再从②口进气,可收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
下列措施中,能提高CH3OCH3产率的有____。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H < 0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
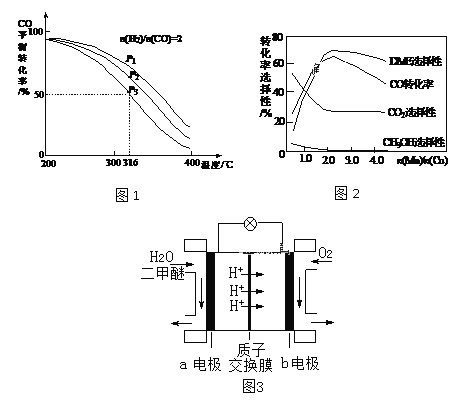
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,具支试管内壁用水湿润后,放入铁粉、碳粉,导管插入到红墨水中。下列描述错误的是( )
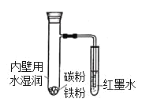
A.具支试管底部发热
B.负极电极反应式:Fe-2e-=Fe2+
C.反应结束后,最终导管内液面下降
D.正极电极反应式:2H2O+O2+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com