
科目: 来源: 题型:
【题目】KMnO4在医疗上有广泛地应用,可用于防腐、制药、消毒等。现以软锰矿(主要成分为MnO2,含有少量Al2O3、SiO2等)为原料制备KMnO4的工业流程如图所示。

(1)料渣的主要成分是____,操作2的意义是__________。
(2)“调pH”的目的是__________;写出“氧化”过程中发生反应的离子方程式:________;熔融过程中,氧化剂与还原剂的物质的量之比为_______。
(3)操作3的内容为蒸发浓缩、趁热过滤、洗涤、烘干,已知KHCO3、KMnO4的溶解度曲线是下图中的两种,则KHCO3、KMnO4的溶解度曲线分别是_____(填序号)。

(4)用惰性电极电解K2MnO4溶液也可得到目标产物,则生成目标产物的电极反应式为___________,充分电解后,得到的溶液中溶质的主要成分是______和KMnO4。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在同温同压下,同体积的气体甲烷(CH4)和二氧化碳密度之比为_________。
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1molL-1,SO42-的物质的量浓度为0.3molL-1,则混合液中K+的物质的量浓度为______________ molL-1 。
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:__________。
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是___ mol;用单线桥标出电子转移的方向和数目。___
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成
是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成![]() 固体,模拟工业上用过氧化氢法制备
固体,模拟工业上用过氧化氢法制备![]() 固体的实验装置如图所示。
固体的实验装置如图所示。
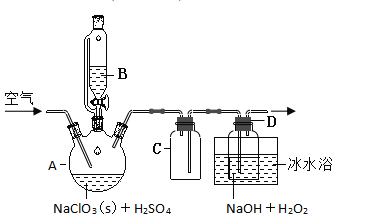
已知:![]() 熔点-59℃、沸点11℃、
熔点-59℃、沸点11℃、![]() 沸点150℃
沸点150℃
![]() 中的化学方程式:
中的化学方程式:![]()
(1)![]() 放入仪器
放入仪器![]() 中,仪器
中,仪器![]() 中的药品是__________(写化学式)。如果仪器
中的药品是__________(写化学式)。如果仪器![]() 改成分液漏斗,实验过程中可能会出现的实验现象__________。
改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)![]() 装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
(3)向![]() 装置中通入空气,其作用是赶出
装置中通入空气,其作用是赶出![]() ,然后通过
,然后通过![]() 再到
再到![]() 中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________。
a.降低![]() 的溶解度 b.减少
的溶解度 b.减少![]() 的分解 c.使
的分解 c.使![]() 变为液态 d.加快反应速率
变为液态 d.加快反应速率
(5)写出![]() 中发生反应的化学方程式__________,
中发生反应的化学方程式__________,![]() 在反应起到__________作用。假设在反应中消耗掉
在反应起到__________作用。假设在反应中消耗掉![]() 则有__________
则有__________![]() 电子转移。
电子转移。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___________,密度______。(填“变大”“变小”或“不变”)。
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】图a是1 mol NO2和1 mol CO恰好反应生成CO2和NO过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的NO2 和CO,反应中的CO和NO的浓度随时间变化的示意图如b图。根据图意回答下列问题:
a 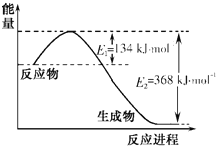 b
b
(1)写出NO2和CO反应的热化学方程式_____________________________________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=_____________。
(3)此温度下该反应的平衡常数K=___________。
(4)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】取9.28g Na2CO3·x H2O溶于水配成5mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20mL,并收集到896mL CO2(标准状况下)。求:
(1)稀盐酸的物质的量浓度;________
(2)x的值。_________
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
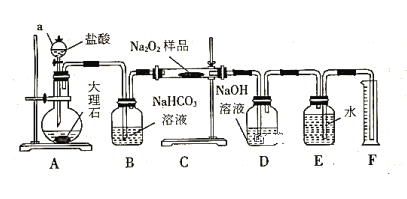
①装置D的作用是_________________________________;
②写出装置C中发生主要反应的化学方程式____________;
③读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)![]() 泄漏会导致人体中毒,用于检测
泄漏会导致人体中毒,用于检测![]() 的传感器的工作原理如图所示:
的传感器的工作原理如图所示:

①写出电极Ⅰ上发生的反应式:__________
②工作一段时间后溶液中![]() 的浓度__________(填“变大”、“变小”或“不变”)
的浓度__________(填“变大”、“变小”或“不变”)
(2)用![]() 氧化
氧化![]() 制取
制取![]() ,可提高效益,减少污染。反应为:
,可提高效益,减少污染。反应为:![]() ,通过控制条件,分两步循环进行,可使
,通过控制条件,分两步循环进行,可使![]() 转化率接近100%,其原理如图所示:
转化率接近100%,其原理如图所示:

过程Ⅰ的反应为:![]()
过程Ⅱ反应的热化学方程式(![]() 用含有
用含有![]() 和
和![]() 的代数式表示)__________。
的代数式表示)__________。
(3)在温度![]() ,容积为
,容积为![]() 的绝热容器中,充入
的绝热容器中,充入![]() ,发生反应:
,发生反应:![]() ,容器中
,容器中![]() 的相关量随时间变化如图所示。
的相关量随时间变化如图所示。

①反应到![]() 时,
时,![]() 的转化率是__________。
的转化率是__________。
②根据图示,以下各点表示反应达到平衡状态的是________。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
③![]() 内容器中
内容器中![]() 的反应速率增大,而
的反应速率增大,而![]() 后容器中
后容器中![]() 的反应速率减小了,原因是_______。
的反应速率减小了,原因是_______。
④此容器中反应达平衡时,温度若为![]() ,此温度下的平衡常数
,此温度下的平衡常数![]() =__________。
=__________。
(4)工业上可用![]() 溶液吸收法处理
溶液吸收法处理![]() ,25℃时用
,25℃时用![]() 的
的![]() 溶液吸收
溶液吸收![]() ,当溶液
,当溶液![]() 时,溶液中各离子浓度的大小关系为:
时,溶液中各离子浓度的大小关系为:![]() 。(已知25℃时:
。(已知25℃时:![]() 的电离常数
的电离常数![]() ,
,![]() )请结合所学理论通过计算说明
)请结合所学理论通过计算说明![]() 的原因__________。
的原因__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
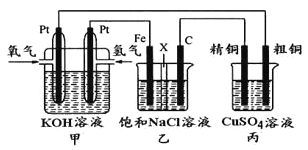
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为______________(填“正极”或“负极”),负极的电极反应式为_________________。
(2)乙装置中铁电极为_______(填“阳极”或“阴极”),石墨电极(C)上发生_____反应(填“氧化”或“还原”),其电极反应式为___________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_____________区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_____;丙装置中阴极析出铜的质量为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是_______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用___________mL量筒最好。
②配制时所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有:___________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足
B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com