
科目: 来源: 题型:
【题目】有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g);ΔH=akJ·mol-1
2H2S(g)+SO2(g)=2H2O(l)+3S(s);ΔH=bkJ·mol-1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s)的ΔH=__kJ·mol-1。
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)体积比一般控制在0.4,理由是__。
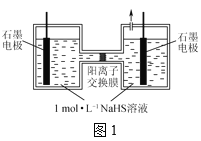
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物Sn2-,S n2-容易被继续氧化而生成硫单质。
①阳极HS-氧化为S n2-的电极反应式为___。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是___。
(3)用CO(NH2)2(N为-3价)水溶液吸收SO2,吸收过程中生成(NH4)2SO4和CO2。该反应中的氧化剂是__。
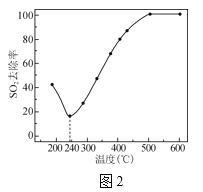
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。240℃以前,随着温度的升高,SO2去除率降低的原因是__。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:


(1)写出物质甲中含氧官能团的名称:________________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):

其中反应Ⅰ的反应类型为_____________,反应Ⅱ的化学方程式为____________(注明反应条件)。
(3)已知:RCH===CHR′![]() RCHO+R′CHO;
RCHO+R′CHO;
2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):

①物质B化学名称为________________,下列物质能与C反应的是________(选填序号)。
a.银氨溶液 b.溴水 c.Na2CO3溶液 d.酸性KMnO4溶液
②写出E→F化学方程式_______________________________________________。
③D的同分异构体中同时满足下列要求的有________种。
a.遇FeCl3溶液显示特征颜色
b.1molD能与2molNaOH溶液反应
c.核磁共振氢谱图中有四个峰,峰面积之比为3:2:2:1
④综上分析,丙的结构简式为__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

(1)装置甲中盛放浓硝酸的仪器A的名称是______,该装置中发生反应的化学方程式为________________________。
(2) 装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x、y、z……表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。

请回答下列问题:
(1)f在周期表中的位置为______________;x形成的阴离子的结构示意图为_____________________。
(2)比较d、e常见离子的半径大小:__________________(填化学式,下同);比较g、h的最高价氧化物对应水化物的酸性强弱:_______________________。
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶2∶1 ∶4,其化学式为__________________________。
②能形成共价化合物,写出其中一种的结构简式____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成氢气和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式:
A.________;B.________;C.________。
(2)写出化学方程式:
①C与水蒸气反应______________________________________________________;
②A与水反应_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是________,被还原的元素是______。
(2)发生氧化反应的物质是__________,发生还原反应的物质是__________。
(3)用双线桥法表示反应电子得失的方向和数目__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为_____,其价层电子排布图为________。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________。“摩尔盐”的分解产物中属于非极性分子的化合物是________。
(3)NH3 的沸点比N2O 的沸点_____(填“高”或“低”),其主要原因是________________。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为_______,与CN- 互为等电子体的单质的分子式为________。HCN 分子中σ键和π键的个数之比为________。
(5)FeO 晶胞结构如下图所示,FeO 晶体中Fe2+配位数为______,若该晶胞边长为acm,则该晶胞密度为________。

查看答案和解析>>
科目: 来源: 题型:
【题目】锌是人体必需的微量元素,[Zn(NH3)4]CO3在生物活性等方面发挥重要的作用。
(1)Zn2+基态核外电子排布式为__。
(2)CO32-的空间构型为__(用文字描述);[Zn(NH3)4]CO3中C、H、O、N四种元素的电负性由小到大的顺序为__。
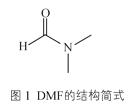
(3)某含锌配合物可用于模拟碳酸酐酶的催化活性,该配合物中含有DMF分子。DMF分子的结构如图1所示。DMF分子中碳原子轨道的杂化类型是__,1molDMF分子中含有σ键的数目为__。
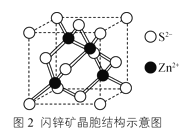
(4)闪锌矿可看作由Zn2+和S2-各自形成的面心立方结构相互穿插而成。其晶胞结构示意图如图2所示,与Zn2+距离相等且最近的Zn2+有__个。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为____________________;
②该反应的正反应为__________反应(“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是____________(填字母代号)。
A.容器中压强不变 B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl,溶液呈碱性的有__________(填序号);常温下0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是 ____________(填离子符号);
②判断Ksp[Mg(OH)2]____________Ksp[Fe(OH)2](填“>”、“=”或“<”)。
(4)电解装置如图所示:
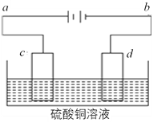
①当用惰性电极电解时,d电极的反应式为____________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量发现两极质量差为16 g,则电路中转移的电子为____________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NaHCO3能与NaOH反应,可用作食品疏松剂
B.N2的化学性质稳定,可用作粮食保护气
C.Fe2(SO4)3易溶于水,可用作净水剂
D.Al(OH)3受热易分解,可用于制胃酸中和剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com