
科目: 来源: 题型:
【题目】已知某饱和氯化钠溶液的体积为V mL,密度为ρ gmL﹣1,质量分数为w,物质的量浓度为c molL﹣1,溶液中所含NaCl的质量为m g.下列选项正确的是
A.该温度下NaCl的溶解度S=![]() g
g
B.溶液中溶质的物质的量浓度c(NaCl)=![]() molL﹣1
molL﹣1
C.溶液中溶质的物质的量浓度c(NaCl)= ![]() molL﹣1
molL﹣1
D.溶液中溶质的质量分数w=![]() %
%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作对应的现象不符合事实的是
A. 将灼烧至黑色的铜丝插入无水乙醇,铜丝变成红色
将灼烧至黑色的铜丝插入无水乙醇,铜丝变成红色
B. 用激光笔照射Fe(OH)3胶体,产生丁达尔效应
用激光笔照射Fe(OH)3胶体,产生丁达尔效应
C.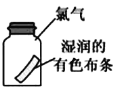 将湿润的有色布条放入盛有干燥氯气的瓶中,布条不褪色
将湿润的有色布条放入盛有干燥氯气的瓶中,布条不褪色
D. 将滴管中的浓盐酸加入碳酸氢钠溶液,气球体积由小变大
将滴管中的浓盐酸加入碳酸氢钠溶液,气球体积由小变大
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
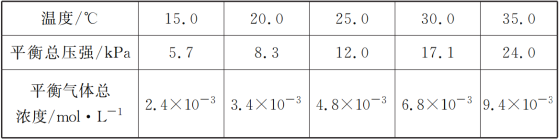
①可以判断该分解反应已经达到平衡的是___________
A. 2v(NH3)=v(CO2)
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时氨基甲酸铵的分解平衡常数表达式为________;平衡常数为________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加”“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS______0(填“>”“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。
NH4HCO3+NH3·H2O。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
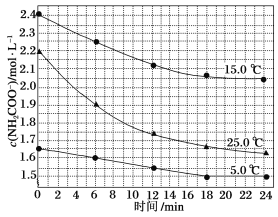
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:_______
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0 ℃时反应物的起始浓度较小,但0~6 min的平均反应速率(曲线的斜率)仍比15.0 ℃时的________(填“大”或“小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:

(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量________(填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:______。甲醇分子中的化学键类型是____(填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是________,发生的是________(填“氧化”或“还原”)反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:_______。
(5)下列事实能表明该反应已达平衡状态的是________(填序号)。
A. CO2(g)的浓度不再发生变化
B. 单位时间内消耗1mol CO2的同时生成3mol H2
C. 在一个绝热的容器中,混合物的温度不再发生变化
D. 在一个容积固定的容器内,压强不再发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置,可以模拟铁的电化学腐蚀,下列说法不正确的是( )

A.若X为碳棒,为减慢铁的腐蚀,开关K应置于N处
B.若X为锌棒,K置于M或N处,均能减慢铁的腐蚀
C.若X为碳棒,将开关K置于M处时铁棒上发生的反应为Fe-2e-=Fe2+
D.若X为锌棒,将开关K置于N处时铁棒上发生的反应为Fe-2e-=Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+![]() O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验与对应的图象符合的是( )
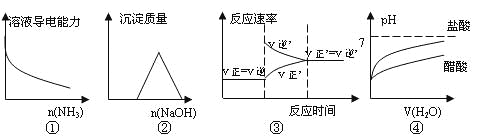
A.①是向一定量的CH3COOH溶液中通入氨气
B.②是向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.③是对于达到平衡状态的![]() 反应,在t1时缩小容器,并在t2时又达到平衡。
反应,在t1时缩小容器,并在t2时又达到平衡。
D.④是将pH=2的盐酸和醋酸分别加水稀释
查看答案和解析>>
科目: 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目: 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】将 NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍、工业上用ClO2气体制 NaClO2的工艺流程如下:
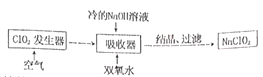
已知: NaClO2的溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。下列说法不正确的是( )
A.流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
B.提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
C.吸收器中生成的NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
D.发生器中反应结束后,向其中通入空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com