
科目: 来源: 题型:
【题目】天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1 g甲烷不完全燃烧生成CO和液态水时放出37.96 kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=______kJ·mol-1
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
①下列措施能够使该反应速率加快的是______。
a.使用催化剂 b.降低温度 c.及时分离水
②若上述反应在恒容的密闭容器中进行,下列叙述中不能说明该反应已达平衡状态的是______。
a.容器内气体的压强不再变化 b.混合气体的质量不再变化
c.c(NO2) = 2c(N2) d.单位时间内生成1molCO2,同时生成2molNO2
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
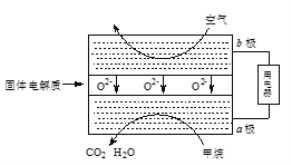
①外电路电子移动方向:____。(填“a极到b极”或“b极到a极”)。
②b极电极反应式为______。
③若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
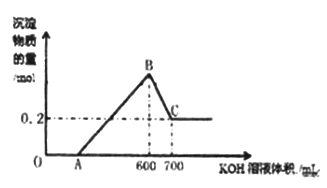
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是____________________。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:______________________。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是____;
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=___mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是_________________。
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
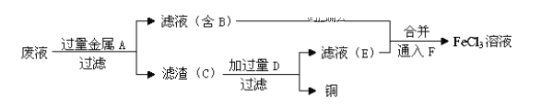
①滤渣C的化学式为___________。
②加过量D发生反应的离子方程式为_________________________。
③通入F发生反应的化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe及其化合物在日常生活中有很多应用,请按要求填空:
(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是_______。(填“还原性”或“氧化性”)
(2)Fe2+是一种非常好的还原剂,能够与很多氧化剂发生反应。在加热条件下,FeSO4可与硫酸酸化的KNO3反应,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NO气体。
①请写出该化学反应方程式,并用单线桥表示出电子转移的方向和数目______。
②上述反应发生还原反应的物质是___。
③若11.4gFeSO4参与反应,则产生NO气体的体积(标况下) ______L。
(3)难溶物FeS能够与硫酸酸化的KMnO4溶液反应,反应方程式如下:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+l0_____+24H2O
①横线上的物质的化学式是。
②该反应的氧化产物是___。
③若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生转移的电子数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:
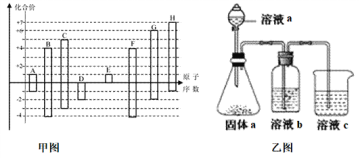
请回答下列问题:
(1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________(写化学式),A和E形成的化合物的电子式为_____________。
(2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示)
(3)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式_________________。
(4)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为________,________(填化学式)。
②溶液c中的离子方程式为__________________________________________。
③请从原子结构的角度解释非金属性C>B的原因____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是

A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为_________mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色溶液中加入过量Na2O2,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入Na2O2的量的关系如图所示,由此确定,原溶液中含有的阳离子是( )
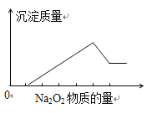
A.Mg2+、Al3+、Fe2+B.H+、Mg2+、Al3+C.H+、Ba2+、Al3+D.NH4+、Mg2+、Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:Ni(OH)2+OH-—e-=NiO(OH)+H2O
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com