
科目: 来源: 题型:
【题目】已知有以下物质相互转化:
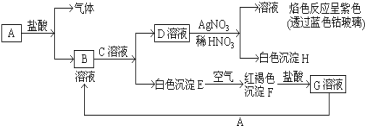
(1)写出下列各物质的化学式:
A___,B____,D___,F___,G___。
(2)写出由E转变成F的化学方程式___。
鉴别溶液G的试剂是__,现象___。
(3)G溶液和A反应的离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
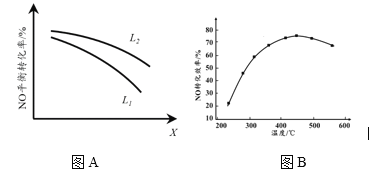
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如下:
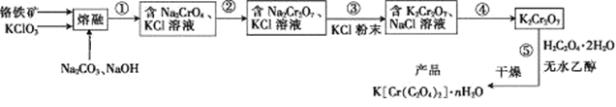
回答下列问题:
(1)若“熔融”在坩埚中进行,其材质可以是____(填“铁”、“陶瓷”或“SiO2”)。
(2) FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____________________________。
(3)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤;二是调节所得滤液pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为______,第二次过滤滤渣的主要成分为_________。
(4)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为___________。
(5)步骤④包含的具体操作有_____、_____,过滤、洗涤,再经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),先写出除杂时所选试剂或者操作,再写出发生的有关化学方程式。
①Fe2O3(Al2O3):___ ___
②FeCl2溶液(FeCl3):___ ___
③Na2CO3(NaHCO3):___ ___
(2)写出以下反应的化学方程式或离子方程式。
呼吸面具中CO2与过氧化钠反应化学方程式:___;
烧碱溶液与铝片的反应离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色。
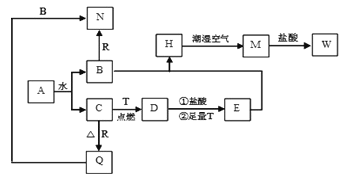
(1)写出下列物质的化学式:A:_____;E:______。
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:_______。
(3)按要求写方程式:B和R反应生成N的离子方程式:____________;M→W的离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填写下列空格。
(1)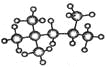 的分子式为:_____________,其一氯代物有_____种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:_____
的分子式为:_____________,其一氯代物有_____种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:_____
(2)分子式为C6H14的烃的主链为4个碳的同分异构体共有______种。
(3)写出实验室制取硝基苯的化学方程式:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】废水中氨氮(NH3、NH4+)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:①微生物脱氮法:NH4+ ![]() NO3-
NO3- ![]() N2;②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
N2;②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
A. 该废水大量直接排放,对水体的影响不大
B. 微生物脱氮时可在高温下进行,以加快脱氮的速率
C. 步骤a发生反应:NH4++2O2=NO3-+H2O+2H+
D. 化学沉淀法脱氮时,溶液的碱性越强,氨氮的去除率将升高
查看答案和解析>>
科目: 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
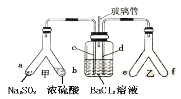
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com