
科目: 来源: 题型:
【题目】某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应如下:4FeS2+11O2![]() 2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
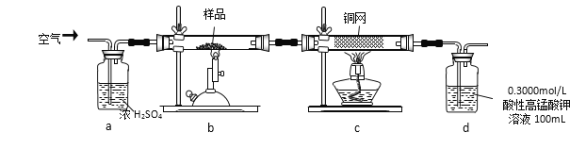
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。(已知:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 )请回答下列问题:
(1)称量样品质量能否用托盘天平_______(填“能”或“不能”),取出d中溶液10mL需要用______准确量取(填序号)
A.容量瓶 B.量筒 C.碱式滴定管 D.酸式滴定管
(2)上述反应结束后,仍需通一段时间的空气,其目的是__________
(3)已知草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为_______________﹔判断滴定到达终点的方法是___________。
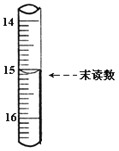
(4)已知滴定管初读数为0.10mL,末读数如图所示,消耗草酸溶液的体积为___________mL。
下列操作会导致该样品中FeS2的纯度测定结果偏高的是_________(填序号)
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)该样品中FeS2的纯度为__________________
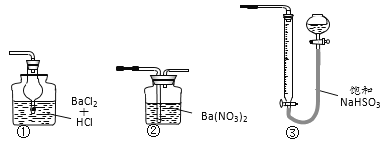
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是_______(填编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
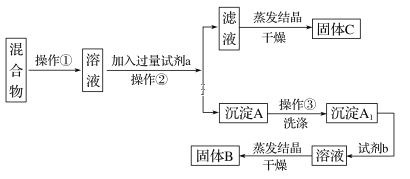
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是__________,试剂a的溶质是__________(填化学式)。
(2)加入试剂b所发生反应的化学方程式为___________________。
(3)洗涤沉淀A的方法____________________。
(4)该方案能不能达到实验目的__________,若不能,应如何改进?(若能,此问不用回答)__________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比可能为( )
A.13:8:29B.22:1:14C.29:8:13D.44:2:23
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
①16gCuSO4·5H2O溶于1L水所得溶液的物质的量浓度为0.1mol/L
②标准状况下,11.2L H2和14g N2所含原子数相同
③1 mol的Cl﹣含有NA个电子
④1mol粒子集合体所含的粒子数与0.012kg C中所含的碳原子相同
⑤同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③B.②⑤⑥C.②④⑤⑥D.①②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中错误的是
A. 锂、钠、钾各1 g,分别与足量的水反应,最剧烈的是锂
B. 锂、钠、钾各1 g,分别与足量的水反应,产生氢气质量最大的是锂
C. 锂、钠、钾各1 g,其中所含原子数最多的是锂
D. 锂、钠、钾失电子能力最强的是钾
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】M表示摩尔质量,NA表示阿伏加德罗常数,Vm表示气体摩尔体积,ω表示溶质的质量分数,ρ(单位为gcm-3)表示溶液的密度。下列说法中不正确的是( )
A.根据摩尔质量和阿伏加德罗常数可以计算得出某气体分子的质量:![]()
B.根据气体摩尔体积和阿伏加德罗常数可以计算得出该条件下某气体分子的大小:![]()
C.根据摩尔质量和气体摩尔体积可以计算得出该条件下某气体的密度:![]()
D.根据溶质的质量分数、摩尔质量和溶液的密度可以计算出某溶液的物质的量浓度:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目: 来源: 题型:
【题目】下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是
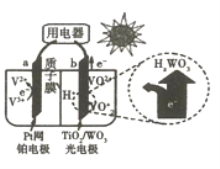
A. 该电池与硅太阳能电池供电原理相同
B. 光照时,H+由a极室通过质子膜进入b极室
C. 光照时,b极反应为VO2++2OH--e-=VO2++H2O
D. 夜间无光照时,a电极流出电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A. 1 g H2和8 g O2
B. 0.1 mol HCl和2.24 L He
C. 150 ℃,1.01×105 Pa时,18 L H2O和18 L CO2
D. 常温常压下,28 g CO和6.02×1022个CO分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com