
【题目】某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应如下:4FeS2+11O2![]() 2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
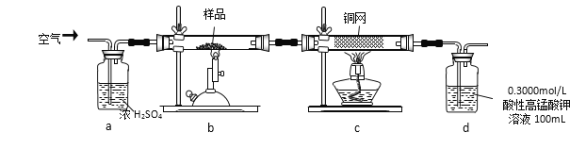
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。(已知:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 )请回答下列问题:
(1)称量样品质量能否用托盘天平_______(填“能”或“不能”),取出d中溶液10mL需要用______准确量取(填序号)
A.容量瓶 B.量筒 C.碱式滴定管 D.酸式滴定管
(2)上述反应结束后,仍需通一段时间的空气,其目的是__________
(3)已知草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为_______________﹔判断滴定到达终点的方法是___________。
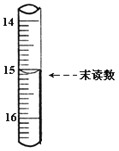
(4)已知滴定管初读数为0.10mL,末读数如图所示,消耗草酸溶液的体积为___________mL。
下列操作会导致该样品中FeS2的纯度测定结果偏高的是_________(填序号)
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)该样品中FeS2的纯度为__________________
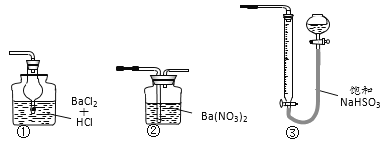
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是_______(填编号)。
【答案】不能 D 促进装置中的二氧化硫气体全部吸收 2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 滴入最后一滴草酸溶液, 溶液由紫红色变为无色,且半分钟内不恢复 15.00 C 90% ②
【解析】
将空气通入浓硫酸中将空气干燥,在b中氧气和二硫化亚铁发生反应为4FeS2+11O2 ![]() 2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2
2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2 ![]() 2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
(1)称量样品质量感量为0.001g,托盘天平感量为0.1g;d中溶液呈酸性且具有强氧化性,应该用酸式滴定管量取;
(2)为使b中生成的二氧化硫全部被d中酸性高锰酸钾溶液吸收,所以实验中应将b装置中二氧化硫全部驱赶到d装置中;
(3)草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O﹔判断滴定到达终点的方法是滴入最后一滴草酸溶液,溶液由紫红色变为无色,且半分钟内不恢复;
(4)依据滴定管的结构,利用开始和结束的体积差值计算得到消耗草酸溶液的体积;滴定过程中如果使用的草酸体积偏大,未与SO2反应的高锰酸钾偏大,则测定的二硫化亚铁的质量分数就偏小;
(5)依据灼烧反应和滴定反应的定量关系计算二硫化亚铁的质量分数;
(6)装置d是用于吸收并测定产物中二氧化硫的含量,根据二氧化硫的化学性质进行判断。
将空气通入浓硫酸中将空气干燥,在b中氧气和二硫化亚铁发生反应为4FeS2+11O2![]() 2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2
2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2![]() 2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
(1)称量样品质量感量为0.001g,托盘天平感量为0.1g,所以不能用托盘天平称量样品质量;d中溶液呈酸性且具有强氧化性,应该用酸式滴定管量取,故答案为D;
(2) 实验的目的是测量FeS2的纯度,为使b中生成的二氧化硫全部被d中酸性高锰酸钾溶液吸收,所以反应结束后,仍需通一段时间的空气,其目的是:将b装置中二氧化硫全部驱赶到d装置中,使SO2被完全吸收;
(3)草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O﹔判断滴定到达终点的方法是滴入最后一滴草酸溶液,溶液由紫红色变为无色,且半分钟内不恢复;
(4)依据滴定管的结构,末读数为15.10mL,利用开始和结束的体积差值计算得到消耗草酸溶液的体积为:15.10mL-0.10mL=15.00mL;
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定,导致草酸浓度降低,则使用的草酸体积偏大,导致未与二氧化硫反应的高锰酸钾物质的量偏大,二硫化亚铁测定值偏低;
B.锥形瓶用蒸馏水洗涤后未用待测液润洗,不影响测定;
C.读取标准液读数时,滴定前平视,滴定到终点后俯视,导致草酸体积偏小,未与二氧化硫反应的高锰酸钾物质的量偏小,二硫化亚铁测定值偏高;
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失,导致草酸体积偏大,未与二氧化硫反应的高锰酸钾物质的量偏大,二硫化亚铁的测定值偏低;
故答案为C;
(5)根据离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,100mL溶液中剩余高锰酸钾物质的量为:![]() ×0.01500L×0.1000mol/L×
×0.01500L×0.1000mol/L×![]() =0.006mol,与二氧化硫反应的高锰酸钾物质的量为:0.3000mol/L×0.1000L-0.006mol=0.024mol,结合反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4可得:
=0.006mol,与二氧化硫反应的高锰酸钾物质的量为:0.3000mol/L×0.1000L-0.006mol=0.024mol,结合反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4可得:
5FeS2~10SO2~4KMnO4
5 4
n(FeS2) 0.024mol
![]() ,解得n(FeS2)=0.03mol,则样品中FeS2的纯度为:
,解得n(FeS2)=0.03mol,则样品中FeS2的纯度为:![]() ×100%=90%;
×100%=90%;
(6)①中溶液不能吸收SO2,无法测定SO2;②中溶液吸收二氧化硫生成硫酸钡沉淀,可测定SO2,可以替代装置d;③SO2中混有的N2等不溶于水,干扰了二氧化硫的测定;故答案为②。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为_____L,它与标准状况下_____L硫化氢含有相同数目的氢原子.
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_____.
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO_____g,该混合气体一定条件下完全转化为二氧化碳后通入2.5mol/L氢氧化钠溶液,最多消耗该氢氧化钠溶液体积__________ml.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
![]()
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________。
②写出氧化过程中的离子方程式:________。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______(填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________和__________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出) ______________(填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。
![]()
(1)该小组同学欲用图所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
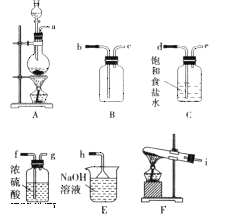
① 应该选择的仪器是__________(填字母)。
② 将各仪器按先后顺序连接起来,应该是a接__________,__________接__________,__________接__________,__________接h(用导管口处的字母表示)。
③ 浓盐酸与二氧化锰反应的离子方程式为__________。
(2)该小组同学设计分别利用图所示装置探究氯气的氧化性。
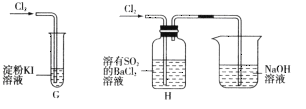
①G中的现象是__________,原因是__________(用化学方程式表示)。
②H中的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解饱和食盐水制取氯气的化学方程式如下:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑.下列表示反应中相关微粒的化学用语正确的是( )
2NaOH+H2↑+Cl2↑.下列表示反应中相关微粒的化学用语正确的是( )
A.Na+的结构示意图: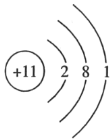
B.中子数为18的氯原子:![]() Cl
Cl
C.NaOH的电子式:![]()
D.Cl2的结构式:Cl=Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物。它的合成路线如图所示。
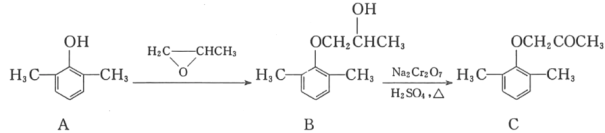
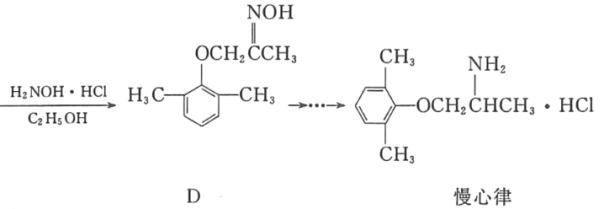
(1)C中的含氧官能团名称为_____和_____;
(2)由B→C的反应类型是_____。
(3)由A制备B的过程中有少量副产物E,它与B互为同分异构体。写出E的结构简式:_____。
(4)写出同时满足下列条件的化合物D的一种同分异构体的结构简式:_____。
①属于a﹣氨基酸;②是苯的衍生物,且苯环上的一氯代物只有两种;③分子中有2个手性碳原子
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(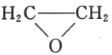 )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚(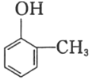 )和乙醇为原料制备
)和乙醇为原料制备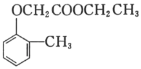 的合成路线流程图(无机试剂任用)。合成路线流程图示例见本题题干_____。
的合成路线流程图(无机试剂任用)。合成路线流程图示例见本题题干_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别为生物体内分子的部分结构模式图,请据图回答问题:
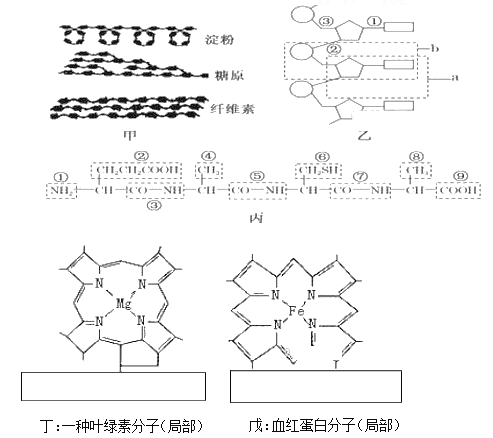
(1)甲图中的三种物质分别属于动物、植物细胞中的储能物质的是_____,组成这三种物质的单体都是_____。
(2)乙图所示化合物的基本组成单位是___________,即图中字母_______________ 所示的结构表示,各基本单位之间是通过_____________(填“①”“②”或“③”)连接起来 的。
(3)丙图是由________个氨基酸经__________ 过程形成的,氨基酸的结构通式为__________ 。检验丙和戊可以用______________ 试剂。
(4)丁和戊中的 Mg2+、Fe2+体现了无机盐具有什么功能?_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com