
����Ŀ����1���ڱ�״���£�1.7g������ռ�����Ϊ_____L�������״����_____L���⺬����ͬ��Ŀ����ԭ�ӣ�
��2��ij��̬������Ļ�ѧʽΪRO2���ڱ�״���£�1.28g������������Ϊ448mL������������Ħ������Ϊ_____��
��3����֪CO��CO2�Ļ������������16.0g����״�������Ϊ8.96L�������֪�û�������к�CO_____g���û������һ����������ȫת��Ϊ������̼��ͨ��2.5mol/L����������Һ��������ĸ�����������Һ���__________ml.
���𰸡�2.24 3.36 64gmol��1 2.80 320
��������
��1������n=![]() ��V=nVm�����ӵĹ��������㣻
��V=nVm�����ӵĹ��������㣻
��2������n=![]() ��V=nVm�������Ħ����������Է�����������ֵ�������������
��V=nVm�������Ħ����������Է�����������ֵ�������������
��3������V=nVm�����û����������������ʵ�������ʽ���㣻
(1)1.7g���������ʵ���Ϊ![]() =0.1mol�������Ϊ0.1mol��22.4L/mol=2.24L��
=0.1mol�������Ϊ0.1mol��22.4L/mol=2.24L��
�������״����VL���⺬����ͬ��Ŀ����ԭ�ӣ���
0.1mol��3=![]() ��2�����V=3.36��
��2�����V=3.36��
�ʴ�Ϊ��2.24��3.36��
(2)��������ʵ���Ϊ![]() =0.02mol�����������Ħ������Ϊ
=0.02mol�����������Ħ������Ϊ![]() =64 gmol��1��
=64 gmol��1��
�ʴ�Ϊ��64 gmol��1��
(3)��״�������Ϊ8.96L��������������ʵ���Ϊ8.96L��22.4L/mol=0.4mol��
��CO��CO2�����ʵ����ֱ�Ϊx��y����
x+y=0.4
28x+44y=16.0�����x=0.1mol��y=0.3mol��
CO������Ϊ0.1mol��28g/mol=2.80g������̼ԭ���غ��֪���ɵĶ�����̼��0.4mol��������̼ͨ������������Һ�����Ķ�����̼���ʱ����̼���ƺ�ˮ�������غ��ϵ��֪�������Ƶ����ʵ�����0.8mol��V=![]() =0.32L=320mL��
=0.32L=320mL��
�ʴ�Ϊ��2.80��320��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڳ��ͷŵ�ʱ�����ķ�ӦΪFe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2�����жԸ����ص��ƶϴ�����ǣ� ��
Fe(OH)2+Ni(OH)2�����жԸ����ص��ƶϴ�����ǣ� ��
�ٷŵ�ʱ��Fe���븺����Ӧ��NiO2����������Ӧ
�ڷŵ�ʱ���������Һ�е��������������ƶ�
�۷ŵ�ʱ�������ϵĵ缫��ӦʽΪFe+2H2O-2e-=Fe(OH)2+2H+
�ܸ����صĵ缫�������ij�ּ��Ե������Һ��
A.�٢�B.�ڢ�C.�٢�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ�ֺ�������������ϵͳԭ��ʾ��ͼ������˵����ȷ����
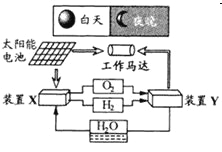
A. ��ϵͳ��ֻ����3����ʽ������ת��
B. װ��Y�и����ĵ缫��ӦʽΪ��![]()
C. װ��X��ʵ��ȼ�ϵ�ص�ȼ�Ϻ�����������
D. װ��X��Y�γɵ���ϵͳ��ʵ�����ʵ����ŷţ�����ʵ�ֻ�ѧ������ܼ����ȫת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ��ĩ��������NaCl��Na2CO3��Na2SO4�е�һ�ֻ�����ɣ�Ϊ������ɷֽ�������ʵ��(ÿ�������Լ�����������):
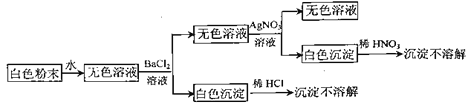
����˵���������ǣ� ��
A.��ĩ��һ������NaClB.��ĩ��һ������Na2SO4
C.��ĩ��һ������Na2CO3D.��ĩ�����Ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. ��״���£�22.4 L�����к���2NA������
B. 0.1NA���Ȼ������ռ�����Ϊ2.24 L
C. 2�˽����Ʊ�ɸ�����ʱʧȥ�ĵ�����Ϊ0.1NA
D. 50 mL 0.1 mol��L-1H2SO4��Һ�к���H+��Ϊ0.005NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
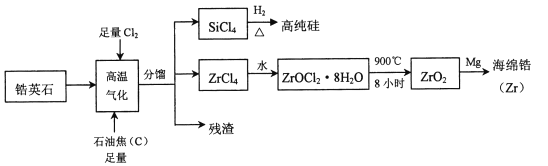
����Ŀ���(![]() )���ִ���ҵ����Ҫ����ԭ�ϣ��������õĿ����ԣ���ʴ���ܳ����ѡ����Ӣʯ(��Ҫ�ɷ���
)���ִ���ҵ����Ҫ����ԭ�ϣ��������õĿ����ԣ���ʴ���ܳ����ѡ����Ӣʯ(��Ҫ�ɷ���![]() ������������
������������![]() ������)Ϊԭ������ﯼ��仯�����������ͼ��ʾ
������)Ϊԭ������ﯼ��仯�����������ͼ��ʾ
(1)д��![]() �ĵ���ʽ____________________��
�ĵ���ʽ____________________��
(2)�������������У���������ʧ�����ַ����õ���![]() ����ͨ�����ɴ�
����ͨ�����ɴ�![]() �����ķ�Ӧ�õ���
�����ķ�Ӧ�õ���![]() �������û�ѧ����ʽ������ԭ��_________________________��
�������û�ѧ����ʽ������ԭ��_________________________��
(3)����������Ĺ��������̼�⣬����![]() ��
��![]() ����ˮ��ȡ���Ȼ�����Һ�����ˣ��������з����̼��
����ˮ��ȡ���Ȼ�����Һ�����ˣ��������з����̼��![]() ���ֹ���ķ�����____________________��
���ֹ���ķ�����____________________��
(4)д������������![]() ��ˮ��Ӧ�Ļ�ѧ����ʽ��____________________________��
��ˮ��Ӧ�Ļ�ѧ����ʽ��____________________________��
(5)��֪�����(![]() )��һ��������������������ƹ����ڿ��γ����Σ���д����ѧ����ʽ_________________________________________��
)��һ��������������������ƹ����ڿ��γ����Σ���д����ѧ����ʽ_________________________________________��
(6)��ҵ�Ͽ��üػ�ԭ![]() ʱ�Ƶý���
ʱ�Ƶý���![]() ��
��![]() ����ԭʱ���ɵļ��ε����ʵ���Ϊ_________________��
����ԭʱ���ɵļ��ε����ʵ���Ϊ_________________��
(7)��֪![]() ��
��![]() ������˵����ȷ����__________
������˵����ȷ����__________
A��![]() ���������Һ��
���������Һ��![]() ��
��![]() ֮�;�Ϊ14
֮�;�Ϊ14
B��������ζ�ijŨ�ȵ�![]() ��Һ���ζ�������
��Һ���ζ�������![]() ������
������
C��![]() ��Һ����μ���������Һ���μӹ�����
��Һ����μ���������Һ���μӹ�����![]() ��С
��С
D��ij�¶���![]() ��������Һ��
��������Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����(����)
A. 1 mol![]() �������������͵�������Ϊ10NA
�������������͵�������Ϊ10NA
B. NA��������6.02��1023����
C. 0.1 mol�����к��е�ԭ������Ϊ0.7NA
D. 1 mol CO������������28NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Na2CO3��NaHCO3��Һ������ͼ��ʾʵ�顣����˵���У���ȷ���ǣ� ��
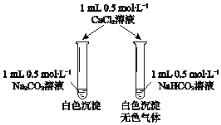
A.ʵ��ǰ�����������Һ�ж��е���ƽ�����
B.ʵ��ǰ����Һ������������ȫ��ͬ
C.����CaCl2��Һ�����ɵij���һ����
D.ʵ��ǰ����Һ��pH��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��ģ�ҵ���Ի�����Ϊԭ���Ʊ�����ĵ�һ����Ӧ������4FeS2+11O2![]() 2Fe2O3+8SO2��������ʵ�飬���ⶨ����Ʒ��FeS2��Ʒ�Ĵ��ȣ������������ʲ����뷴Ӧ����
2Fe2O3+8SO2��������ʵ�飬���ⶨ����Ʒ��FeS2��Ʒ�Ĵ��ȣ������������ʲ����뷴Ӧ����
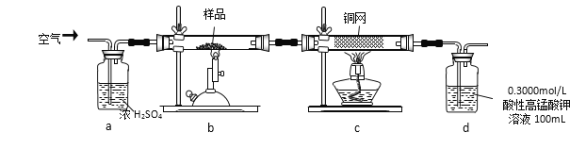
ʵ�鲽�裺��ȡ��ϸ����Ʒ4.000g������ͼbװ���У�Ȼ���ڿ����н������ա�Ϊ�ⶨδ��Ӧ������ص�������������Һ������ֲ��䣩��ʵ����ɺ�ȡ��d����Һ10mL������ƿ���0.1000mol/L����(H2C2O4)����Һ���еζ�������֪��5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 ����ش��������⣺
��1��������Ʒ�����ܷ���������ƽ_______������������������������ȡ��d����Һ10mL��Ҫ��______ȷ��ȡ(�����)
A������ƿ B����Ͳ C����ʽ�ζ��� D����ʽ�ζ���
��2��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����__________
��3����֪������������������Һ������CO2��Mn2+���������ɣ���ζ�ʱ������Ӧ�����ӷ���ʽΪ_______________�r�жϵζ������յ�ķ�����___________��
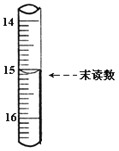
��4����֪�ζ��ܳ�����Ϊ0.10mL��ĩ������ͼ��ʾ�����IJ�����Һ�����Ϊ___________mL��
���в����ᵼ�¸���Ʒ��FeS2�Ĵ��Ȳⶨ���ƫ�ߵ���_________(�����)
A.ʢ����Һ�ĵζ���������ˮϴ�Ӻ�δ�ñ�Һ��ϴ��װҺ�ζ�
B.��ƿ������ˮϴ�Ӻ�δ�ô���Һ��ϴ
C.��ȡ��Һ����ʱ���ζ�ǰƽ�ӣ��ζ����յ����
D.�ζ�ǰ�ζ��ܼ��촦������δ�ų����ζ���������ʧ
��5������Ʒ��FeS2�Ĵ���Ϊ__________________
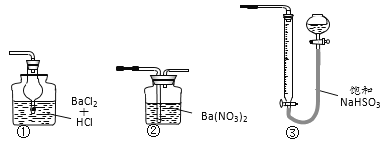
��6��������ͼװ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ���_______�����ţ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com