
【题目】工业上电解饱和食盐水制取氯气的化学方程式如下:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑.下列表示反应中相关微粒的化学用语正确的是( )
2NaOH+H2↑+Cl2↑.下列表示反应中相关微粒的化学用语正确的是( )
A.Na+的结构示意图: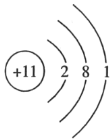
B.中子数为18的氯原子:![]() Cl
Cl
C.NaOH的电子式:![]()
D.Cl2的结构式:Cl=Cl
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 1 mol![]() 所含的质子数和电子数都为10NA
所含的质子数和电子数都为10NA
B. NA个微粒就是6.02×1023个微粒
C. 0.1 mol硫酸中含有的原子总数为0.7NA
D. 1 mol CO所含电子数是28NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B分别为第三、四周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数。
①若A为第ⅡA族元素,其质量数为x,则B的质子数为y。
②若A为第ⅣA族元素,其质子数为m,则B的质量数为n。
则y和n的值分别是
A. (![]() +18)、(2m+18)B. (
+18)、(2m+18)B. (![]() +8)、(2m+18)
+8)、(2m+18)
C. (![]() +8)、(2m+36)D. (
+8)、(2m+36)D. (![]() +18)、(2m+36)
+18)、(2m+36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应如下:4FeS2+11O2![]() 2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
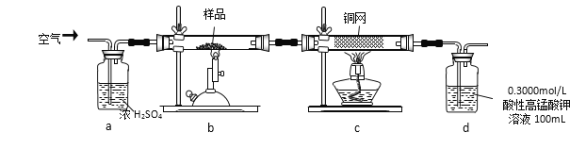
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。(已知:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 )请回答下列问题:
(1)称量样品质量能否用托盘天平_______(填“能”或“不能”),取出d中溶液10mL需要用______准确量取(填序号)
A.容量瓶 B.量筒 C.碱式滴定管 D.酸式滴定管
(2)上述反应结束后,仍需通一段时间的空气,其目的是__________
(3)已知草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为_______________﹔判断滴定到达终点的方法是___________。
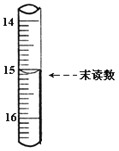
(4)已知滴定管初读数为0.10mL,末读数如图所示,消耗草酸溶液的体积为___________mL。
下列操作会导致该样品中FeS2的纯度测定结果偏高的是_________(填序号)
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)该样品中FeS2的纯度为__________________
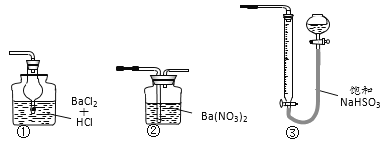
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是_______(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
(有效成分)NaClO
(规格)1000ml
(质量分数)37.25%
(密度)1.2g.cm-3
(1)该“84消毒液”的物质的量浓度约为________mol·L-1(保留2位有效数字)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)_____mol·L-1(保留小数点后2位)。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制230 mL含NaClO质量分数为37.25%的消毒液。
①需要称量NaClO固体的质量为___________g
②其操作步骤可分解为以下几步:
A.将称量准确的NaClO固体,放入烧杯里,加适量蒸馏水使其溶解,并用玻璃棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
C.将NaClO溶液小心地用玻璃棒引流容量瓶里D.检查250mL容量瓶,是否漏水
E.将蒸馏水直接加入容量瓶,至液面接近刻度线
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
完成上述步骤中的空白处_____________________;正确的操作顺序是(用字母填写):_______________;进行A步骤操作时,必须__________后,才能进行后面的操作。
(4)“84消毒液”与稀硫酸混合使用可增加消毒能力,某消毒小组人员用98%(密度为1.84g/ml)的浓硫酸配制100ml4.6mol/L的稀硫酸,用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol/L;
②需要量取浓硫酸的体积为__________ml。
(5)将所配制的稀H2SO4进行测定,发现实际浓度小于4.6 mol·L-1。请你分析下列哪些操作会引起所配浓度偏小_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.洗涤量筒中的液体注入烧杯
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题。
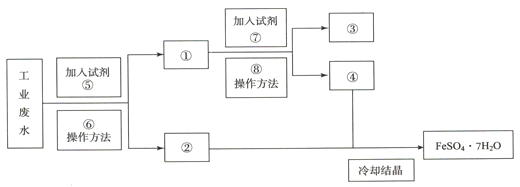
(1)写出下列标号所代表的物质的名称(注意用量)或操作方法③_____,⑥_____。
(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是______,现象依次是_______,并写出对应反应的离子方程式:_______,______。
(3)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,此过程涉及的氧化还原反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明气孔的张开与保卫细胞膜上的H+—ATPase有着非常密切的关系。H+—ATPase被蓝光诱导激活后就会利用ATP水解释放的能量将H+分泌到细胞外,此时内向K+离子通道开启,细胞外的K+转移进保卫细胞;同时其他相关阴离子在H+协助下也进入保卫细胞,从而使气孔张开。气孔张开运动的相关机理如下图所示。
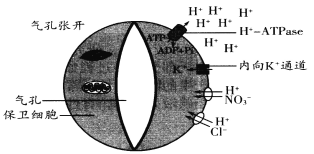
注:图中两个细胞贴近气孔部分细胞壁较厚,伸缩性较小,外侧较薄
(1)保卫细胞膜上的H+—ATPase被激活时,细胞内的H+通过____________的方式转移出保卫细胞;据细胞吸水与失水的原理推测,蓝光诱导后气孔张开的原因是__________________。
(2)植物有时为防止水分过度散失气孔会关闭,此时叶肉细胞仍可进行光合作用,消耗的CO2可来自___________和___________,但光合速率会明显减慢;气孔开启瞬间植物叶肉细胞消耗C5的速率会___________(填“增大”或“减小”或“不变”)。
(3)科研人员利用转基因技术在拟南芥保卫细胞中表达了由光控制的K+通道蛋白BL,试图提高气孔动力,即光照增强时气孔打开的更快,光照减弱时关闭的也更快。
①欲探究BL蛋白是否发挥了此功能,可在变化的光照强度和恒定光照强度下,分别测正常植株和转基因植株的气孔动力,该实验的自变量是_____________________。
②若实验表明BL蛋白发挥了预期的作用,而在恒定光照强度下生长的转基因株系生物量积累和用水效率方面,与正常植株无明显差异,说明____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com