
科目: 来源: 题型:
【题目】Ⅰ.实验室利用铜和稀硝酸制备一氧化氮:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,该反应的离子方程式为___。每生成11.2LNO(标准状况),转移的电子数为___NA。
Ⅱ.(1)在发射“神舟”十一号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) ΔH1;
H2O(l)==H2O(g) ΔH2
请写出液态肼与足量过氧化氢反应生成氮气和液态水的热化学方程式:_____。
(2)在25℃,101kPa下,1molCO完全燃烧放出283.0kJ的热量。请写出表示CO燃烧热的热化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:_________;
②KHSO4:___________;
(2)写出下列物质在水溶液中的离子方程式:
③HNO3与醋酸钠(CH3COONa):____________;
④Na2CO3与澄清石灰水反应:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
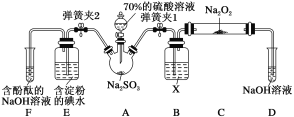
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸溶液至浸没三颈烧瓶中的固体。若将带火星的木条放在D试管口处,木条不复燃,说明SO2与Na2O2反应无O2生成,可能发生的化学方程式为____。
(2)关闭弹簧夹1,打开弹簧夹2,残余气体进入E、F中。E中的现象为___,E中反应的离子方程式为___。F中的现象为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18 g·mL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度c(HCl)=__ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中(HCl)= ___mol·L-1。
(3)取稀释后盐酸溶液100mL,该溶液中所含的氯离子的个数为:N(Cl—)=___NA
(4)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积是___L。
查看答案和解析>>
科目: 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O==Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是:

A. Ag2O电极是正极
B. 电子由Zn电极流出,经过KOH溶液流入Ag2O电极
C. Zn电极的电极反应式:Zn-2e-+2OH-==Zn(OH)2
D. 溶液中OH-向负极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列比较中,正确的是:
A. 常温下,pH=11的Na2CO3溶液中,水电离出的c(OH-)=1.0×10-3molL-1
B. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 加热蒸干AlCl3溶液可得到AlCl3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】准确移取20.00mL某待测 NaOH溶液于锥形瓶中,用0.1000mol·L-1盐酸滴定。用酚酞作指示剂,下列说法不正确的是:
A. 常温下,0.1000mol·L-1盐酸pH=1
B. 酸式滴定管用蒸馏水洗涤后,再用盐酸润洗
C. 随着盐酸的滴入,锥形瓶中溶液pH逐渐变小
D. 当滴入最后一滴盐酸时,溶液由无色变为浅红色,且30s内不褪色,即为滴定终点
查看答案和解析>>
科目: 来源: 题型:
【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】世界能源消费依靠化学技术,作为燃料的H2通常来自水煤气。回答下列问题:
(1)己知:① C(s)+H2O(g)=CO(g)+H2(g)△H=akJ/mol②2C(s)+O2(g)=2CO(g) △H= -220 kJ/mol③2H2O(g)=2H2(g)+O2(g) △H=+480 kJ/mol,则 a=_____kJ/mol。
(2)某实验小组在实验室模拟反应C(s) +H2O (g)![]() CO (g) +H2 (g)能够说明该反应达到平衡状态的是____。
CO (g) +H2 (g)能够说明该反应达到平衡状态的是____。
a. v逆(H2O)=v正(CO) b.容器中物质的总质量不发生变化
c. n (H2O):n (H2)=1:1且不再改变 d.恒容容器中混合气体密度不变
(3)一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O发生反应①,6min时生成0.7 gH2则6 min内以CO表示的平均反应速率为 ______mol/Lmin-1 (保留2位有效数字)。
(4)燃料气中CO需氧化为CO2与氢气进行分离,使用CuO/CeO2做催化剂,并向其中加入不同的酸(HIO3 或H3PO4)后,CO的转化率随温度的变化如图所示。
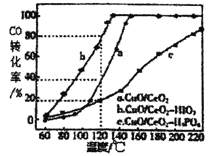
①加入H3PO4__________(填“促进”或,抑制”)CuO/CeO2的催化。
②CeO2可由草酸鋪[Ce2(C2O4)3]在空气中灼烧制备,同时只产生一种气体,写出该反应的化学方程式_____。
③恒温恒压下,在温度为120°C,催化剂为CuO/CeO2HIO3条件下反应,若起始时燃料气流速为1800mLmin-1,其中CO的体积分数为0.68%,则反应0.5h后剩余气体中CO的体积为__mL。
(5)有人将合成氨反应设计成原电池,装置如图所示。
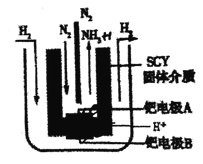
①正极反应式为 _______。
②己知该原电池的标准电动势![]() ,25°C时反应的平衡常数K与
,25°C时反应的平衡常数K与![]() 之间的关系为
之间的关系为![]() (n为原电池反应转移的电子数),则合成氨反应(N2 +3H2
(n为原电池反应转移的电子数),则合成氨反应(N2 +3H2![]() 2NH3)的平衡常数K为 ______(用含a的代数式表示,不需要化简)。
2NH3)的平衡常数K为 ______(用含a的代数式表示,不需要化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com