
【题目】(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:_________;
②KHSO4:___________;
(2)写出下列物质在水溶液中的离子方程式:
③HNO3与醋酸钠(CH3COONa):____________;
④Na2CO3与澄清石灰水反应:__________。
【答案】Ba(OH)2=Ba![]() +2OH
+2OH![]() KHSO4=K
KHSO4=K![]() +H
+H![]() +SO4
+SO4![]() H
H![]() +CH3COO
+CH3COO![]() =CH3COOH CO3
=CH3COOH CO3![]() + Ca
+ Ca![]() =CaCO3↓
=CaCO3↓
【解析】
(1)①氢氧化钡为强电解质,完全电离;②硫酸氢钾为强电解质,完全电离;
(2)①二者反应生成硝酸钠和醋酸;②二者反应生成碳酸钙和氢氧化钠;
据此分析解答。
(1)①氢氧化钡为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-,故答案为:Ba(OH)2=Ba2++2OH-;
②硫酸氢钾为强电解质,完全电离,电离方程式:KHSO4=K++H++SO42-,故答案为:KHSO4=K++H++SO42-;
(2)③HNO3与醋酸钠(CH3COONa),离子方程式:H++CH3COO-=CH3COOH,故答案为:H++CH3COO-=CH3COOH;
④Na2CO3与澄清石灰水反应生成碳酸钙和氢氧化钠,离子方程式:CO32-+Ca2+=CaCO3↓,故答案为:CO32-+Ca2+=CaCO3↓。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
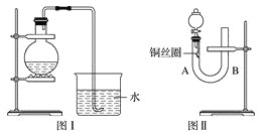
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,体积为VL两容器分别充满了CO气体和CO2气体,下列有关说法不正确的是( )
A.两容器含有气体分子数目相同
B.两容器气体密度之比为:7:11
C.两容器中所含氧原子个数之比为:1:2
D.两容器所含气体的物质的量均为:![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确移取20.00mL某待测 NaOH溶液于锥形瓶中,用0.1000mol·L-1盐酸滴定。用酚酞作指示剂,下列说法不正确的是:
A. 常温下,0.1000mol·L-1盐酸pH=1
B. 酸式滴定管用蒸馏水洗涤后,再用盐酸润洗
C. 随着盐酸的滴入,锥形瓶中溶液pH逐渐变小
D. 当滴入最后一滴盐酸时,溶液由无色变为浅红色,且30s内不褪色,即为滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液450 mL:
(1)配制溶液时,一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为_________,本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有________。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为___g,要完成本实验该同学应称出____g NaOH.。
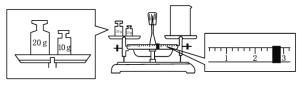
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是____。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸镁[主要含MgCO3和Mg(OH)2]是制取氧化镁的工业原料。某研究性学习小组用如图所示装置确定轻质碳酸镁的组成。向广口瓶B中加入足量1.00 mol·L-1稀硫酸,充分反应后测得D装置增重0.88 g;向B所得溶液中加入足量NaOH溶液,过滤,将所得沉淀洗涤、低温干燥、称量所得Mg(OH)2固体为1.45 g。
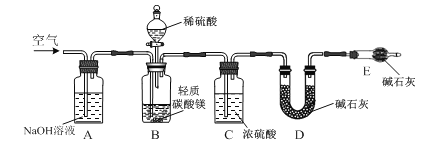
⑴ 反应后需向装置A中缓缓鼓入空气,目的是________。
⑵ 某同学旋转分液漏斗下面的活塞,发现液体不能顺利流下,可能的原因是________。
⑶ 由浓硫酸配制100mL 1.00 mol·L-1的硫酸,下列操作会使所配溶液浓度偏低的是________填字母)。
A.容量瓶使用前未干燥,有少量水残留
B.定容时,俯视容量瓶刻度线
C.加水时超过刻度线,用胶头滴管吸出多余的液体
D.稀释浓硫酸时未冷却至室温就将溶液转移入容量瓶
⑷ 该轻质碳酸镁中MgCO3和Mg(OH)2物质的量的比值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量Fe2O3和Al2O3的混合固体溶解在200mL 0.1mol·L-1的过量H2SO4溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A. 0.4 mol·L-1 B. 0.2 mol·L-1
C. 0.1 mol·L-1 D. 0.8 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com