
科目: 来源: 题型:
【题目】某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题:
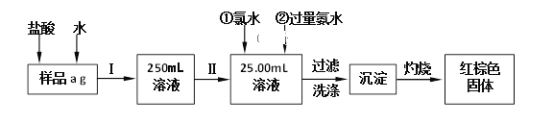
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______。
(2)写出加入氯水发生的离子反应方程式________________________________。
(3)写出加入过量氨水发生的离子反应方程式_______________________________。
(4)写出灼烧发生反应的化学方程式_______________________________。
(5)检验沉淀是否已经洗涤干净的操作是______________________________。
(6)下列操作可能使所配溶液浓度偏小的是__________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____________。
查看答案和解析>>
科目: 来源: 题型:
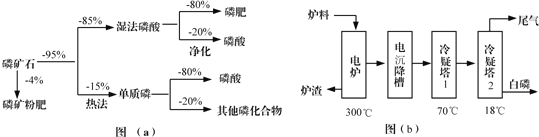
【题目】化学一选修:化学与技术磷矿石主要以[Ca3(PO4)2H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:
部分物质的相关性质如下:
熔点/℃ | 沸点/℃ | 备注 | |
白磷 | 44 | 280.5 | |
PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的____________;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:___________,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸___________t。
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是___________(填化学式),冷凝塔1的主要沉积物是___________,冷凝塔2的主要沉积物是___________。
(4)尾气中主要含有___________,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去___________;再通入次氯酸钠溶液,可除去___________(均填化学式)。
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。
| |||||
A | B | C | D | E | F |
(1)写出装置A中两种主要玻璃仪器的名称__________、_______。
(2)写出装置A中发生的离子方程式____________________________。
(3)装置B的作用是______________________________。
(4)写出装置C中发生反应的主要化学方程式:______________________________。
(5)装置D中 NaOH的作用是________________________________________。
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为__________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)AgNO3的水溶液呈________________(填“酸”、“中”、“碱”)性,常温时的pH_____7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______________________________________________________________________________________;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈_______性 ,原因是(用离子方程式表示):_____________________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某儿童微量元素体检报告单的部分数据,根据数据,回答下列问题:
北京市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ |
| 7.52~11.82 |
3 | 钙(Ca) | 1.68 |
| 1.55~2.10 |
(1)该儿童体内_________元素含量偏低。
(2)报告单中“μmol·L-1”是__________(填“质量”“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的________性。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,将硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是_______________________。
(5)取补血剂片用研钵研细,加入过量稀硫酸,取澄清液,然后滴加KSCN溶液,若溶液变为红色,则溶液中含有________(填离子符号),说明补血剂是否变质____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
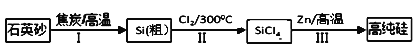
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】基本知识填空
(1)在一定条件下,当一个可逆反应的_____与____相等时,反应物的浓度与生成物的浓度不再改变,即达到化学平衡状态。
(2)化学平衡状态的特征:_____、____、_____、_____、_____。
(3)对于可逆化学反应mA+nBpC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:______。
(4)强电解质包括的范围:____、____、____。弱电解质包括的范围:____、_____、____、_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系。根据要求回答问题:
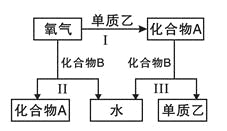
(1)上图三个反应中,属于氧化还原反应的有____个。
(2)若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有____。
A.还原性:H2R>H2O B.酸性:H2R>H2O
C.稳定性:H2R<H2O D.沸点:H2R<H2O
(3)若化合物B常温下为气体,其水溶液呈碱性(答题必须用具体物质表示)。
①化合物B的电子式为______;其水溶液呈碱性的原因是______(用离子方程式表示)。
②化合物B可与O2组成燃料电池(氢氧化钾溶液为电解质溶液),其反应产物与反应Ⅲ相同。写出该电池负极的电极反应式______________________。
③当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为△H1和△H2,则反应Ⅰ的热化学方程式为______________(注:反应条件相同、所有物质均为气体)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.23g Na与足量H2O反应完全后可生成NA个H2分子
B.标准状况下,11.2L H2O中含有的氧原子数为0.5NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.16g O2含有的氧原子数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下,其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________________。
(2)混合气体中碳原子的个数为______________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,剩余气体最后收集在气球中(实验在标准状况下测定)。
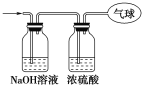
①气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
②气球的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com