
科目: 来源: 题型:
【题目】愈创木酚作原料合成香草醛的路线如图所示,下列说法正确的是( )
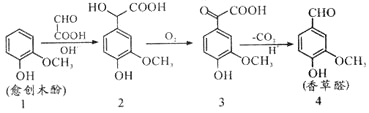
A.检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
B.化合物2在一定条件下可发生加聚反应
C.理论上反应1→2中原子利用率100%
D.等物质的量的四种物质与足量NaOH溶液反应,消耗NaOH物质的量比为1:3:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于常见有机化合物的说法中,正确的是( )
A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应
B.分子式为![]() 的有机物只有三种,它们互为同分异构体
的有机物只有三种,它们互为同分异构体
C.石油、天然气和煤的主要成分都是烷烃
D.己烯和苯都能使溴水褪色,故不能用溴水鉴别己烯和苯
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是___。
(2)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是___;过一会儿,溶液颜色逐渐褪去,起作用的成分是___;
(3)鉴别Na2CO3和NaHCO3溶液可选用___。(填序号)
①NaOH ②Ca(OH)2 ③BaCl2 ④K2SO4 ⑤Ca(NO3)2
(4)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。
①其中被还原的元素是___。
②当反应有3.612×1024个电子转移时被硝酸钾氧化得到的氧化产物在标准状况下的体积___。
(5)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是___,R的相对原子质量是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某稻壳灰的成分为
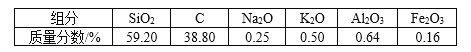
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是________。
(2)步骤①中涉及SiO2的离子反应方程式为______________。
(3)滤渣A的成分有________和_________(填化学式)。
(4)滤渣B的成分是________(填化学式)。
(5)过滤所需的玻璃仪器除烧杯和玻璃棒外,还有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),请按要求回答下列问题。
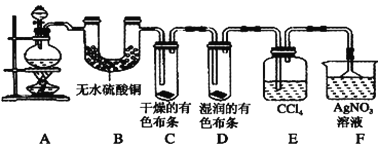
(1) 实验室制备Cl2所用的化学药品是________。
写出该反应的离子方程式,并用单线桥表示电子转移情况_____________________ ,此反应中每转移0.8mol电子,消耗Hcl____mol
(2)①装置B的作用是_______
②装置C和D出现的不同现象说明的问题是___
③装置E的作用是_______
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置___与___之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为___(填字母序号)。
A.湿润的碘化钾淀粉试纸 B.浓硫酸 C.湿润的红色布条 D.饱和食盐水
Ⅱ.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:_____________。
②漂白粉的有效成分是________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。
回答下列问题:
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制C12,Cu和稀HNO3制NO。
①制取NO的离子方程式为________________________
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为____(气流方向从左至右)。
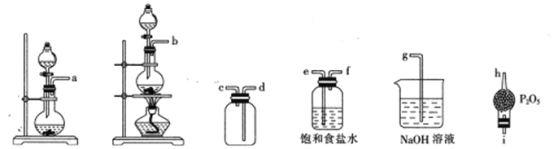
(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如下所示:
反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:
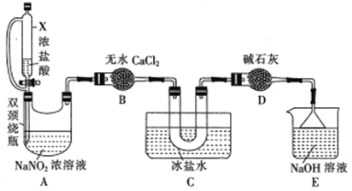
①仪器X的名称为_______,用它代替分液漏斗的优点是_________________
②装置C的U形管中观察到的现象是____________,装置D的作用是_________
(3)取少量产品NOCl滴入盛有水的试管中,液面上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料来制取氧化钴(Co2O3),是我国生产氧化钴常见的工业方法之一。其生产流程如下:
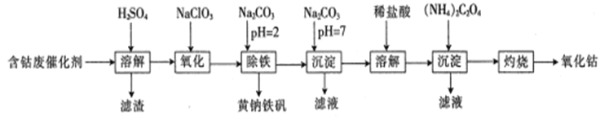
已知:KMnO4的氧化性强,可以氧化HBr、HCl、Fe2+等。
请回答以下问题:
(1)“溶解”前,需将含钴废催化剂粉碎的目的是____________,“溶解”后所得滤渣的主要成分是________________(填化学式)。
(2)“氧化”的目的是将Fe2+氧化成Fe3+,该反应的离子方程式为__________;实验中能否选用KMnO4溶液检验Fe2+是否完全氧化?______ (填“能”或“不能”),理由是______________________________。
(3)“除铁”步骤中,当Fe3+与CO32-的物质的量相等时,恰好完全反应生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_____________
(4)加入Na2CO3溶液后生成“沉淀”,过滤后需用水洗涤沉淀,检脸沉淀已经洗涤干净的方法是______________
(5)现取10.0g含钴废催化剂(含钴的质量分数为70.8%)模拟以上生产流程进行实验,最终得到7.47g氧化钴,则该实验的产率为__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1234.8kJ·mol-1
结论:C2H5OH的燃烧热 △H=-1234.8 kJ·mol-1
B. 稀溶液中有H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
结论:将稀醋酸与NaOH的稀溶液混合后,若有1 mol H2O生成,则放出的能量等于57.3kJ
C. C(s,石墨)=C(s,金刚石) △H=+1.5kJ·mol-1
结论:相同条件下金刚石比石墨稳定
D. Sn(s,灰)![]() Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
结论:锡制品在寒冷的冬天更容易损坏
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

已知:氢化物指的是由氢元素和另一种元素组成的化合物,例如NH3就是氮元素的一种氢化物。
(1)X的化学式为________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为_____________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S
C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的氯化钡溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.0025mol。
③准确量取25.00mL溶液A,加入适量的稀硫酸酸化后,用0.02mol·L-1 KMnO4溶液滴定至终点(KMnO4只与加合物中的H2O2发生反应),消耗KMnO4溶液25.00mL。回答下列问题:
(1)在步骤①中,所需玻璃仪器除了烧杯外还需要________________;
(2)在步骤①中,下列操作会使所配溶液浓度偏低的是_______(填字母);
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视仪器上的刻度线
C.定容后震荡摇匀静置,发现液面低于刻度线,于是又加入少量水至刻度线
D.配制前容量瓶中有少量水
(3)③中的KMnO4溶液置于_______(“酸式”或“碱式”)滴定管中,滴定终点的现象是____________________,写出滴定中发生的离子反应方程式_______________;
(4)通过计算确定样品的组成为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com