
科目: 来源: 题型:
【题目】研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4min~8min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
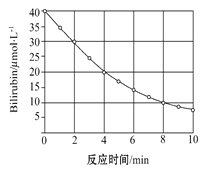
A. 2.5μmol·L-1·min-1和2.0μmol·L-1
B. 2.5μmol·L-1·min-1和2.5μmol·L-1
C. 3.0μmol·L-1·min-1和3.0μmol·L-1
D. 3.0μmol·L-1·min-1和2.5μmol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol Na被完全氧化生成Na2O2,失去2NA个电子
B. 0.5mol锌粒与足量的盐酸反应产生H2为11.2L
C. 电解58.5g熔融的氯化钠,能产生23.0g金属钠、22.4L氯气(标准状况)
D. 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、G为中学化学中常见的物质,其中A为单质,B、C、D、G均为化合物。它们之间存在以下的相互转化关系:
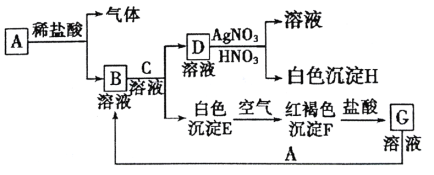
试回答:
(1)写出A的化学式___。
(2)如何用实验证明B溶液中是否含有G?(请写出实验的步骤、现象和结论)___。
(3)写出由E转变成F的化学方程式___。
(4)向G溶液中加入A的有关离子反应方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用下图装置研究硝酸的性质。
Ⅰ实验一:甲同学用图1装置来证实稀硝酸与铜反应生成NO。
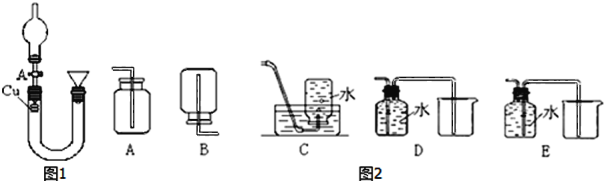
(1)请写出稀HNO3与Cu反应的离子方程式___。
(2)从A中向U形管中注满稀硝酸后,关闭A,待反应结束后,如何证明生成的无色气体气体是NO,操作是___。
(3)图2收集NO气体的各种装置中,合理的是___(填序号,多选不给分)。
(4)在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol·L-1、0.2mol·L-1,向该混合液中加入2.56g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是___。
Ⅱ.实验二、乙组同学利用上述装置完成浓硝酸与铜的反应
(5)同学们发现实验室里有几瓶浓硝酸呈黄色,请用化学方程式和简单的文字说明解释这种现象___。
(6)同学们发现反应后的溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了NO2气体所致。同学们分别设计了以下4个实验来判断两种看法是否正确。
这些方案中可行的是___(填序号,多选不给分)
①加热该绿色溶液,观察颜色变化
②加水稀释绿色溶液,观察颜色变化
③向该绿色溶液中通入氮气,观察颜色变化
④向饱和硝酸铜溶液中通入NO2气体,观察颜色变化
查看答案和解析>>
科目: 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0 t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备“三盐”的工艺流程如图所示。
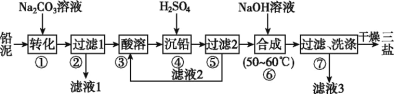
已知:①Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;②铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式:_____,该反应能发生的原因是________。
(2)步骤②“过滤1”后所得滤渣的主要成分为__________。
(3)步骤③“酸溶”,最适合选用的酸为__,为提高酸溶速率,可采取的措施是___________(任意写出一条)。
(4)从原子利用率的角度分析该流程的优点为__________。
(5)步骤⑥“合成”的化学方程式为___________________。若得到纯净干燥的“三盐”49.5 t,假设铅泥中的铅元素有80%转化为“三盐”,则铅泥中铅元素的质量分数为____%(结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
A. ①④⑤⑥ B. ①③④⑥ C. ①②③⑤ D. ②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是一种非天然氨基酸,其合成路线如下:
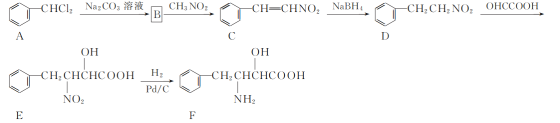
(1) C中官能团的名称为________。
(2) D→E的反应类型为________。
(3) B的分子式为C7H6O,写出B的结构简式:________。
(4) D的一种同分异构体X同时满足下列条件,写出X的结构简式: ________。
①六元环状脂肪族化合物;
②能发生银镜反应,1 mol X反应能生成4 mol Ag;
③分子中只有4种不同化学环境的氢。
(5) 写出以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】浓硫酸与木炭粉在加热条件下反应:C+H2SO4(浓)![]() CO2↑+SO2↑+2H2O
CO2↑+SO2↑+2H2O
Ⅰ.第一小组用如图所示各装置设计一个实验,验证上述反应所产生的三种产物。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(1)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→ → → 。___
(2)实验时可观察到装置A瓶的溶液褪色,C瓶的溶液不褪色;A瓶溶液变化体现了SO2___性;B瓶溶液的作用是___,B瓶中对应反应的离子方程式是___;C瓶溶液的作用是___。
(3)装置②中看到现象是___。
(4)装置③中所加试剂名称是___,现象是___。
Ⅱ.另一个小组为测得CO2和SO2的质量,并计算两者物质的量之比,设计下列实验:
将生成气体依次通过X溶液→浓硫酸→碱石灰1→碱石灰2,并设法让气体完全被吸收。
(5)下列试剂中适合充当X的是___
A.BaCl2溶液 B.Ba(OH)2溶液
C.滴加H2O2的BaCl2溶液 D.滴加H2O2的Ba(OH)2溶液
(6)实验结束后,在X溶液中得到的沉淀通过过滤、洗涤、烘干、称重,称得质量为4.66g。称得碱石灰1(足量)在实验前后增重质量为1.32g。CO2和SO2物质的量比___。
查看答案和解析>>
科目: 来源: 题型:
【题目】双氧水是重要的化学试剂。
(1)一定条件下,O2得电子转化为超氧自由基(·O![]() ),并实现如下图所示的转化:
),并实现如下图所示的转化:
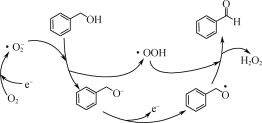
①![]() 是________(填“氧化”或“还原”)反应。
是________(填“氧化”或“还原”)反应。
②写出图示转化总反应的化学方程式:________。
(2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为________。
(3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应:K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平)
再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应:
反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O
反应2:H2O2+CH3COOH===CH3COOOH+H2O
则该鸡尾酒中CH3CH2OH的物质的量浓度为________mol·L-1(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com