
科目: 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)___c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是___(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH)=____。
(2)某温度下,pH=3的盐酸中[OH-]=10-9mol/L。该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为____。
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
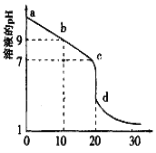
①d点所示的溶液中离子浓度由大到小的顺序依次为______。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=_____(写出准确数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是重要的化工原料。以乙炔为起始物进行的一些转化关系如下:
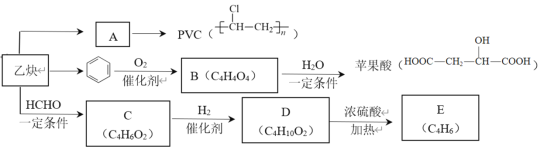
已知:①1molB与足量NaHCO3溶液反应生成标准状况下的CO2 44.8L
②乙炔与甲醛1:2反应生成C
请回答下列问题:
(1)写出下列反应的反应类型: A → PVC__________;乙炔 → C__________ 。
(2)写出下列物质的结构简式:B __________;C__________ 。
(3)写出下列反应的化学反应方程式:乙炔 → A__________;D → E__________;
(4)写出一种既能发生水解反应,又能发生银镜反应的C的同分异构体的结构简式___________________________ 。
(5)1,3-丁二烯也能合成苹果酸。请选用必要的无机试剂,补充下列合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。____
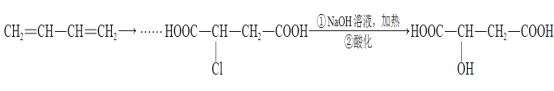
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
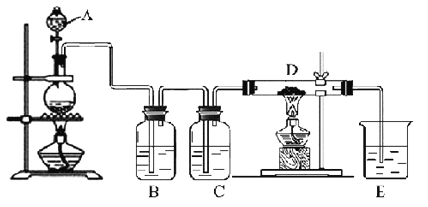
(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化镁(MgO2)不溶于水,与酸反应生成H2O2,在医学上可作解酸剂。常温下MgO2较稳定,加热时会分解生成O2和MgO。MgO与H2O2反应可制得MgO2,同时放出大量热。一种制备MgO2的流程如图所示:
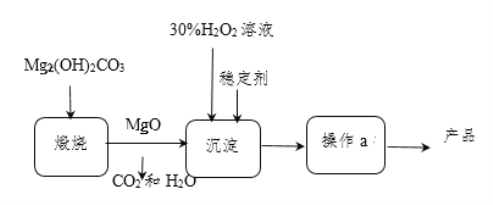
请回答下列问题:
(1)煅烧Mg2(OH)2CO3的化学反应方程式为_______________________;检验Mg2(OH)2CO3已分解完全的方法是______________________________。(写出实验操作和现象)
(2)上述制备过程中加入稳定剂的作用是___________;操作a为_____________。
MgO2产品中常会混有少量MgO,实验室可通过多种方案测定样品中MgO2的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中MgO2的含量。
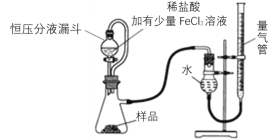
(3)研究小组的实验原理是(用化学方程式表示)①___________________________;
②2H2O2 → 2H2O +O2↑,稀盐酸中加入少量FeCl3溶液的作用是_______________。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、___________。
(5)反应结束后,先_________________,然后__________________,最后平视刻度线读数并记录。
(6)该小组记录的实验数据如下,样品的质量为m g;反应开始前量气管的读数为a mL;反应结束后量气管的读数为b mL,则样品中过氧化镁的质量分数为______(该实验条件下O2密度为ρ gL-1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
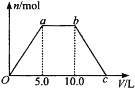
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对烟道气中的SO2进行吸收或回收再利用具有一定的社会和经济价值。
请回答下列问题:
(1)用NaOH溶液吸收SO2 ,写出相关反应的离子方程式_______________________。
(2)已知NaHSO3溶液显酸性,比较NaHSO3溶液中c(H2SO3)_____ c(SO32-)(填“>”“<”或“=”),请简述判断理由____________________________________________。
烟道气中的SO2,也可通过如下反应回收硫:2CO(g)+SO2(g)![]() S(s)+2CO2(g) + Q kJ。某温度下,在2 L恒容密闭容器中通入2 mol SO2和一定量的CO,发生上述反应,5 min后达到平衡,生成1 mol CO2。
S(s)+2CO2(g) + Q kJ。某温度下,在2 L恒容密闭容器中通入2 mol SO2和一定量的CO,发生上述反应,5 min后达到平衡,生成1 mol CO2。
(3)一定条件下,上述反应的能量变化如图1,则 Q =_________kJ。
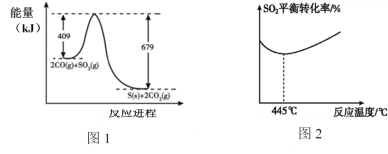
(4)写出该反应平衡常数表达式________;0~5min内SO2的平均反应速率为________。
(5)对反应2CO(g)+SO2(g)![]() S(s)+2CO2(g) + Q kJ的分析正确的是_______。
S(s)+2CO2(g) + Q kJ的分析正确的是_______。
a.若混合气体密度保持不变,则反应已达平衡状态
b.从反应开始到平衡时,容器内气体的压强保持不变
c.平衡时,其它条件不变,分离出硫,正反应速率加快
d.平衡时,其它条件不变,再充入一定量CO2,平衡常数保持不变
(6)其他条件不变时,随着温度的升高,SO2的平衡转化率随温度的变化曲线如图2所示,请解释其可能的原因________________________________。(已知硫的沸点约是445°C)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列五种溶液:盐酸、NH3·H2O、NH4HSO4、NaOH、CH3COOH。回答下列问题:
(1)将1LpH=2的HCl溶液分别与0.01mol·L-1的NH3· H2O溶液x L、0.01 mol·L-1的NaOH溶液yL充分反应至中性,x、y大小关系为:y___x(填“>”“<”或“=”)。
(2)H+浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是____(填写序号)。
①反应所需要的时间CH3COOH >HCl
②开始反应时的速率HCl>CH3COOH
③参加反应的锌粉物质的量HCl=CH3COOH
④反应过程的平均速率CH3COOH>HCl
⑤HCl溶液里有锌粉剩余
⑥CH3COOH溶液里有锌粉剩余
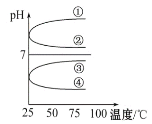
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,升高温度(溶质不会分解)溶液pH随温度变化如图中的____曲线(填写序号)。
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1NaOH溶液至中性,得到的溶液中:c(Na+)+c(NH4+)___2c(SO42- )(填“>”“=”或“<”);用NH4HSO4与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH___7(填“>”“=”或“<”)
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是____(用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:___________;磷原子核外有_____种能量不同的电子。
(2)上述反应的反应物和生成物中含有非极性键的分子是______。(写出物质的化学式)
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列___________________。
(4)NH3的稳定性比PH3的(填“强”或“弱”)_________,判断理由是____________。
(5)A、配平上述反应,并标出电子转移方向与数目_________
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1mol氧化产物,转移电子的数目为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示:

下列说法不正确的是( )
A.图中![]() 代表H2O2
代表H2O2
B.步骤i、ii的总反应方程式是![]()
C.由上图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2
D.根据以上原理,推测步骤vi生成HCOOH和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com