
科目: 来源: 题型:
【题目】(1)有Mg、Al混合粉末10.2 g溶于50 mL 4 mo1·L-1的盐酸,若加入2mo1·L-1的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠的体积为_____mL。
(2)标准状况下,将足量的Zn投入到一定量的浓硫酸中,完全反应后,收集到336 mL气体,将该气体通入足量氯水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知该气体中SO2的体积分数为________。
(3)某化学学习小组在进行知识整理时发现如下规律:有些反应随着溶液由浓变稀,可能导致“量变引起质变”,并据此拟定了如下几个相关题目,请你给出相应答案。
I.实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑(MnO2不能氧化稀盐酸)。用下列两种方法制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。不考虑HCl的挥发,则两种方法生成的氯气的量是方法①____(填“>”、“<”或“=”)方法②。
MnCl2+2H2O+Cl2↑(MnO2不能氧化稀盐酸)。用下列两种方法制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。不考虑HCl的挥发,则两种方法生成的氯气的量是方法①____(填“>”、“<”或“=”)方法②。
II.用100 mL、18 mo1·L-1的浓硫酸与足量的铜充分反应后,溶液中硫酸根离子的物质的量____(填“>”、“<”或“=”)0.9 mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
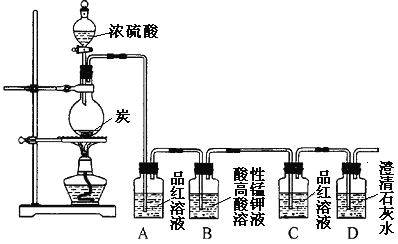
(1)烧瓶中发生反应的化学反应方程式是___________。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____,通过洗气瓶C中无现象和___的现象,证明反应有_______(填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______(填名称)具有______的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】下图装置可作集气瓶和洗气瓶。现有以下5种气体:①Cl2②NH3③NO④NO2⑤SO2 (作答请填序号)。
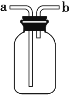
(1)若集气瓶是干燥的,则由b口进气可收集的气体有______。
(2)若集气瓶充满水,可收集的气体有_______;此时气体由______口进入。
(3)若集气瓶内装入浓硫酸进行气体干燥,不能用此装置干燥的气体是____。若干燥时气体由____口进入。
查看答案和解析>>
科目: 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A. ①④⑥B. ①②④C. ②③⑤D. ③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是
①1∶3 ②2∶3 ③1∶4 ④2∶7 ⑤任意比
A.①④B.⑤C.②③D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组以苯乙烯和乙烯为主要原料,设计出医药中间体G的合成路线如图:
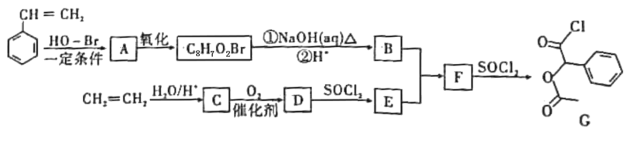
已知RCOOH![]() RCOCl
RCOCl![]() RCOOR’。
RCOOR’。
(1)B中含氧官能团的名称为___;D的结构简式为___。
(2)乙烯的某种同系物的化学名称为“甲基丙烯”,则甲基丙烯的结构简式为___。
(3)B能通过分子间脱水生成有机物X,X可用于香料,其结构中含有三个六元环状结构,则B转化为X的化学方程式:___。
(4)M是G的同分异构体,符合下列结构和性质的芳香族化合物M共有___种(不考虑立体异构)。
①1molM与银氨溶液反应最多能得4molAg;
②苯环上有四个取代基,其相对位置为![]() ;
;
③核磁共振氢谱为5组峰,且峰面积为2:2:2:2:1;
④M能发生消去反应。
写出M发生消去反应的化学方程式:___(一例即可)。
(5)设计出以甲苯为原料制备B的合成路线(无机试剂任选,已知:RCHO![]()
![]() ,RCN
,RCN![]() RCOOH)___。
RCOOH)___。
合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu(In1-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]___;Ga、In、Se,第一电离能从大到小顺序为___。
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是___。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是___。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为___。
(4)SeO32-的立体构型为___;SeO2中硒原子采取杂化类型是___。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
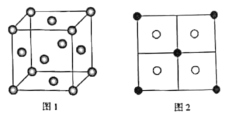
①CuS晶体中,相邻的两个铜离子间的距离为___pm。
②Cu2S晶体中,S2-的配位数为___。
③Cu2S晶体的密度为ρ=___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)汽车尾气中常含有碳烟、CO、NO等有害物质,尾气中含有碳烟的主要原因为___。
(2)已知在298K和101kPa条件下,有如下反应:
反应①:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
反应②:N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol-1
若反应![]() CO2(g)+
CO2(g)+![]() N2(g)
N2(g)![]() C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)CO2(g)+N2(g)的活化能为___kJ·mol-1。
C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)CO2(g)+N2(g)的活化能为___kJ·mol-1。
(3)在常压下,已知反应2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH(298K)=-113.0kJ·mol-1,ΔS(298K)=-145.3J/(mol·K),据此可判断该反应在常温下___(填“能”或“不能”)自发进行。
(4)向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g),NO和N2的物质的量变化如表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1kPa、p2kPa。
物质的量/mol | T1℃ | T2℃ | |||||
0 | 5min | 10min | 15min | 20min | 25min | 30min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~10mi内,以NO表示的该反应速率v(NO)=___kPa·min-1。
②第15min后,温度调整到T2,数据变化如表所示,则p1___p2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,再次达平衡时NO的体积百分含量为___。
(5)为探究温度及不同催化剂对反应2NO(g)+2CO(g)+N2(g)+2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示:

①在催化剂乙作用下,图中M点对应的速率(对应温度400℃)v正___v逆(填“>”、“<”或“=”),其理由为___。
②温度高于400℃,NO转化率降低的原因可能是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com