
科目: 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=![]() ,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式____。
(2)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正____υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中___点,比较图中B、D两点所对应的正反应速率υB_____υD,理由是____。

(3)一定条件下要提高反应物的转化率,可以采用的措施是___。
a.升高温度 b.加入催化剂 c.压缩容器的体积 d.增加水蒸气的浓度 e.及时分离出产物
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
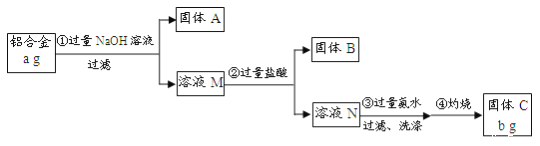
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2;2NaOH+SiO2=Na2SiO3+H2O;Na2SiO3+
2HCl=2NaCl+H2SiO3↓。
请回答下列问题:
(1)固体A的成分是_______;
(2)步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______。(用a、b表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
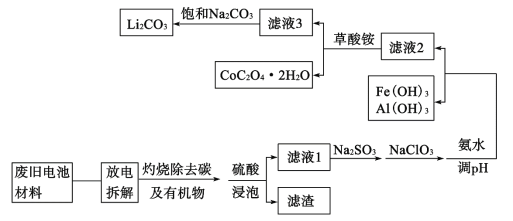
(1)“拆解”前需进入“放电”处理的目的是__;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__。
(3)滤液1中加入Na2SO3的主要目的是__;加入NaClO3的主要目的是__。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图沉钴时应控制n(C2O42-):n(Co2+)比为__,温度控制在__℃左右。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)高温下,C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0,反应的化学平衡常数表达式K=____ ,该反应随温度升高,K值___(填增大、减小或不变),该反应在高温下自发进行的原因是_____。
CO(g)+H2(g) ΔH>0,反应的化学平衡常数表达式K=____ ,该反应随温度升高,K值___(填增大、减小或不变),该反应在高温下自发进行的原因是_____。
(2)向重铬酸钾溶液中加入氢氧化钠固体,溶液的颜色变化为____,原因是(请从平衡的角度用化学用语及必要的文字说明)____。
(3)密闭容器中充入N2O4达化学平衡,压缩体积达新平衡,整个过程的现象为____。
(4)多元弱酸的逐级电离平衡常数为K1、K2、K3……,则K1、K2、K3的大小关系为___。
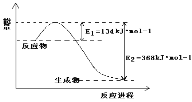
(5)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式___,向上述可逆反应中加入催化剂,则E1____(填增大、减小或不变,下同);此反应的ΔH____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各表述与示意图一致的是( )
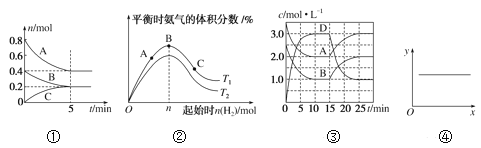
A. ①反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
C. ③A(g)+B(g)![]() C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
D. ④2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各表述与示意图一致的是
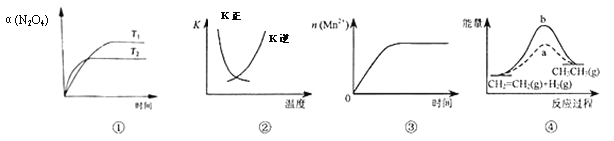
A. 图①表示N2O4(g)![]() 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
B. 图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: M是人们日常生活中一种重要调料,也是一种重要的化工原料,在灼烧时,焰色反应呈黄色。A、B、D均为单质,在F的溶液中加入硫氰化钾溶液,溶液变成血红色,各物质的转化关系如下图所示:

根据以上信息回答下列问题:
(1)M和水发生电解的化学方程式____________。
(2)写出E溶于水的电离方程式__________。
(3)F和D反应生成G的离子方程式为____________。
(4)向G的溶液中滴加C的溶液,观察到的现象为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
2min末浓度/mol/L | 0.08 | a | b |
平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20% B. t℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 D. 前2min内,用Y的变化最表示的平均反应速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列填空。甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:

(1)若甲是不溶于水的白色固体,是刚玉的主要成分,且既能溶于硫酸又能溶于氢氧化钠溶液;乙的酸根中含有金属元素。写出下列物质间的转化: 甲![]() 乙的离子方程式___;丙
乙的离子方程式___;丙![]() 甲的化学方程式____。
甲的化学方程式____。
(2)若甲是无色气体,也是形成酸雨的物质;乙在标准状况下为无色晶体。 写出下列物质间的转化:甲![]() 乙的化学反应方程式____________;丙
乙的化学反应方程式____________;丙![]() 甲的化学反应方程式_________。
甲的化学反应方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示的反应判断下列说法中错误的是

A. CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com