
科目: 来源: 题型:
【题目】Na2S2O3应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)Na2S2O3的实验室制法:装置如图(加热和夹持装置略):

已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中发生反应的化学方程式为______。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:______。

③丙中,NaOH溶液吸收的气体可能有______。
(2)实际工业生产中制得的Na2S2O3溶液中常混有少量Na2SO3,结合溶解度曲线(如图),获得Na2S2O35H2O的方法是______。
(3)Na2S2O3的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反应的原理为:
i.Cu(NH3)42+ + Au + 2S2O32![]() Cu(NH3)2+ + Au(S2O3)23+ 2NH3
Cu(NH3)2+ + Au(S2O3)23+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH
浸金过程Cu(NH3)42+起到催化剂的作用,金总反应的离子方程式为:______。

② 一定温度下,相同时间金的浸出率随体系pH变化曲线如如图,解释pH>10.5时,金的浸出率降低的可能原因_______。(写出2点即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X是药物的中间体,它的一种合成路线如下。
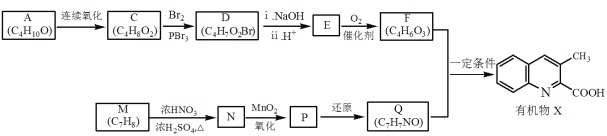
已知:RNH2+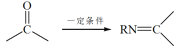 +H2O
+H2O
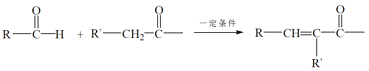
(1)A无支链,A中含有的官能团名称是___。
(2)A连续氧化的步骤如下:
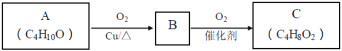
A转化为B的化学方程式是___。
(3)M为芳香化合物,其结构简式是___。
(4)M→N的化学方程式是___,反应类型是___。
(5)下列说法不正确的是___。
a.1molD与NaOH溶液反应时,最多消耗2molNaOH
b.E在一定条件下可生成高分子化合物 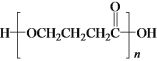
c.F能发生酯化反应和消去反应
(6)Q的结构简式是___。
(7)以乙烯为起始原料,选用必要的无机试剂合成A,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4![]() MgxMo3S4,下列说法正确的是( )
MgxMo3S4,下列说法正确的是( )
A.电池充电时,阴极发生还原反应生成Mo3S4
B.电池充电时,阳极反应为xMg-2xe-===xMg2+
C.电池放电时,Mg2+向负极迁移
D.电池放电时,正极反应为Mo3S4+2xe-+xMg2+=== MgxMo3S4
查看答案和解析>>
科目: 来源: 题型:
【题目】LED系列产品是被看好的一类节能新产品,下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是
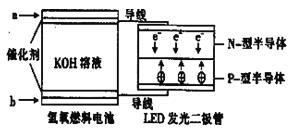
A.a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O
B.b处通入氧气,为电池的正极
C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
D.P-型半导体连接的是电池负极.
查看答案和解析>>
科目: 来源: 题型:
【题目】将反应Cu(s) + 2Ag+(aq)![]() Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
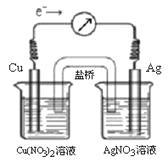
A. KNO3盐桥中的K+移向Cu(NO3)2溶液
B. 当电流计指针为0时,该反应达平衡,平衡常数K=0
C. 若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
D. 若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
查看答案和解析>>
科目: 来源: 题型:
【题目】周期表前四周期的元素![]() 、
、![]() 、
、![]() 、
、![]() ,原子序数依次增大,X原子基态时
,原子序数依次增大,X原子基态时![]() 层中
层中![]() 轨道电子数与s轨道电子数相同;
轨道电子数与s轨道电子数相同;![]() 原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;
原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;![]() 位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
(1)X位于周期表的第_______周期,第______族。
(2)元素的第一电离能:X______Y(填“>”或“<”,下同);原子半径:X______Y。
(3)![]() 的最高价氧化物对应水化物中酸根离子的空间构型是_______(用文字描述)。
的最高价氧化物对应水化物中酸根离子的空间构型是_______(用文字描述)。
(4)![]() 基态核外电子排布式为_________,用铁氰化钾溶液检验
基态核外电子排布式为_________,用铁氰化钾溶液检验![]() 的离子方程式为___________。
的离子方程式为___________。
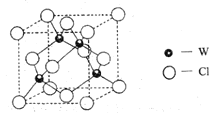
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是_______,它可与浓盐酸发生非氧化还原反应,生成配合物![]() ,反应的化学方程式:_________。
,反应的化学方程式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3水解的离子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B. NH4Cl溶于D2O中:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
C. Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。

(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比![]() 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,分别调节浓度均为0.1 mol·L-1 HA溶液、HB的溶液的pH,所得溶液中酸分子的百分含量ω%(如HA的百分含量为![]() ×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
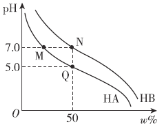
A.常温下,Ka(HA)=1.0×10-5B.M、N两点对应离子浓度:c(A-)=c(B-)
C.将M、N两点溶液等体积混合,溶液呈中性D.水的电离程度:M=N>Q
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+ H+,下列说法正确的是
CH3COO-+ H+,下列说法正确的是
A.向体系中加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
B.向体系中加水稀释,平衡向右移动,溶液中所有离子的浓度都减小
C.加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大
D.升高体系温度(忽略醋酸挥发),溶液中H+数目增多,平衡一定向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com