
科目: 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.所含的电子数由多到少的顺序是:SO2>CO2>O2>CH4>H2
D.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L氢气中含有2NA个中子
B. 0.1NA个氯化氢分子占有体积为2.24 L
C. 2克金属钙变成钙离子时失去的电子数为0.1NA
D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
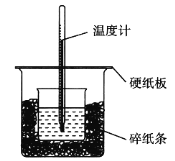
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:
(1)写出碳原子最外层电子的轨道表示式______________,其最外层有____种不同运动状态的电子。
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:_____________________________________________________。
(3)下面是工业上冶炼Cr时涉及到的反应:
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平____________________。
②上述反应中,若转移了3mol电子,得到的还原产物是__________mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式________。
(4)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。Ni(CO)4是________________晶体,Ni(CO)4易溶于下列_______(填序号)。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__。平衡时H2的转化率为___。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__。平衡时H2的转化率为___。
(2)平衡后,若要提高H2的转化率,可以采取的措施有___。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1___K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是___(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为___。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正___v(N2)逆(填“<”、“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为___。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正___v(N2)逆(填“<”、“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是___。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是

A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能溶液呈酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
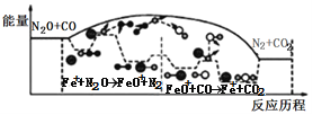
A.反应总过程是放热的
B.Fe+作为催化剂改变了反应途径,提高了反应速率
C.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应
D.若反应在恒容密闭容器中进行,温度越高,反应速率一定越快
查看答案和解析>>
科目: 来源: 题型:
【题目】图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是

A.粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去
B.阳离子交换膜允许Na+通过,而阻挡了Cl2进入B室
C.a处得到的是浓NaOH溶液
D.饱和食盐水从B室底部加入
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁储量居世界首位。用含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2流程如下:

已知反应TiO2++2H2O![]() H2TiO3+2H+ ΔH<0
H2TiO3+2H+ ΔH<0
(1)步骤①加Fe的目的是___________________________________(用离子方程式表达);步骤②冷却的目的是_________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是__________________;考虑成本和废物综合利用因素,废液中应加入______处理;在“水浸”步骤中加入大量的水即可获得H2TiO3沉淀,请用相关化学原理解释___________________________________________________。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为
![]() ―→
―→![]()
![]()
![]()
反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com