
科目: 来源: 题型:
【题目】α1和α2分别为A在甲、乙两个恒容容器中平衡体系A(g)+B(g)![]() C(g)和2A(g)
C(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1、α2均减小B. α1、α2均增大C. α1减小,α2增大D. α1增大,α2减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在容积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是
2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是
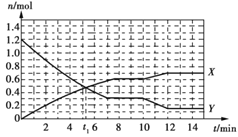
A. t1 min时,正、逆反应速率相等
B. 曲线X表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的化学反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的化学反应速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含的质子数由多到少是:CO2>SO2>CH4>O2>H2
C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
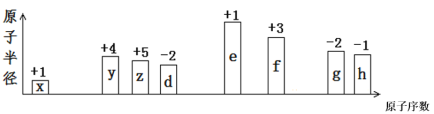
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)比较d、e常见离子的半径大小(用化学式表示)___________________;
(3)z的简单氢化物与z的最高价氧化物的水化物形成的化合物中化学键类型为:_______________________。
(4)元素y的一种同位素可用于测定文物年代,这种同位素原子符号为___________。
(5)元素g与元素h相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________(填序号)。
a.常温下g的单质和h的单质状态不同
b.h的氢化物比g的氢化物稳定
c.一定条件下g和h的单质都能与氢氧化钠溶液反应
d.g、h最高价氧化物对应水化物的酸性前者弱于后者
(6)x、e反应可生成离子化合物ex。
①写出化合物ex的电子式__________________。
②将少量ex投入水中,剧烈反应,得到x单质。
写出反应的化学方程式:_____________________________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】采用如图装置制取一定量的饱和氯水,并进行氯水的性质实验。
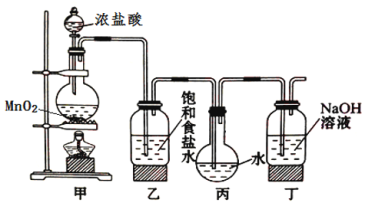
(1)在装入药品前应进行的操作____________________________________________。
(2)写出丁装置中发生反应的离子方程式:_______________________。
(3)用制得的饱和氯水分别进行下列实验:
①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是___________;
②滴到蓝色石蕊试纸上的现象:_________________________________________。
(4)久置的氯水漂白效果明显不足或消失,用化学方程式表示:_________________。
(5)将制得的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种(简要文字说明):
①__________________________________________________________________;
②__________________________________________________________________。
用实验证明红色褪去的原因是①或者②的实验方法是:___________。
(6)科学家提出,使用氯气对自来水消毒时,氯气会与水里的有机物反应,生成的有机氯化物可能对人体有害,现已开始使用新的自来水消毒剂,如_________________(举两例,写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,密闭容器中发生反应aX(g) ![]() bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A. 可逆反应的化学计量数:a>b+c
B. 达到新平衡时,物质X的转化率减小
C. 压缩容器的容积时,υ正增大,υ逆减小
D. 达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题。
(1)为了防止FeSO4溶液变质,应在溶液中加入少量的_________(元素符号表示)。
(2)人体血液中的下列物质不属于电解质的是_________(填序号,下同)。
a.H2CO3 b.葡萄糖(C6H12O6)
c.NaHCO3 d.NaCl
(3)区分Na2CO3和NaHCO3溶液可选用的方法或试剂是_________。
a.CaCl2溶液 b.焰色试验
c.Ca(OH)2溶液 d.NaOH溶液
(4)下列变化中,不涉及氧化还原反应的是_________。
a.金属的冶炼 b.钢铁的锈蚀
c.钟乳石的形成 d.食物的变质
(5)下列过程必须加入氧化剂才能实现的是_________。
a.Cl2→ClO- b.NH3→NH4+
c.KMnO4→MnO2 d.Fe2+→Fe3+
(6)质量相同的两份铝粉,分别放入足量的盐酸和NaOH溶液,放出的H2在同温同压下体积之比为__________________。
(7)明矾〔硫酸铝钾的结晶水合物:KAl(SO4)2·12H2O〕是一种常用添加剂,明矾在水中能电离出两种金属离子和酸根离子。写出硫酸铝钾电离方程式:_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1:1 ⑦混合气体总质量 ⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧B. ①③④⑤C. ①②③④⑤⑦D. ①③④⑤⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com