
科目: 来源: 题型:
【题目】用化学用语表示2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:![]()
B.中子数为10的氧原子:![]() O
O
C.Na+的结构示意图:![]()
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单二苯乙炔类化合物是![]() 。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
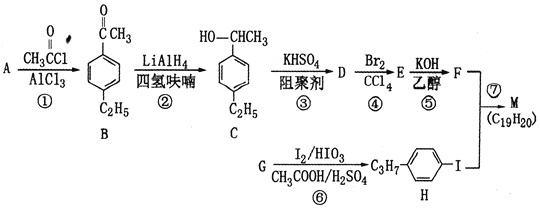
回答下列问题:
(1)G的结构简式为________________。
(2)C中含有的官能团名称是________________________。
(3)反应②的反应类型是________________,反应⑥的反应类型是________________。
(4)反应⑤的化学方程式为____________________。
(5)能同时满足下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有两个取代基 ②能发生银镜反应
写出其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式_______。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线。_________________________
的合成路线。_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为__________(填元素符号)。Y的氢化物的分子空间构型是_______。其中心原子采取_____杂化,属__________(填“极性”或“非极性”)分子。
(2)E元素基态原子的电子排布式为_______________________________。
(3)XZ2分子中含有________个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是____________________________。
(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为___________。
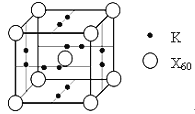
查看答案和解析>>
科目: 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnCl24H2O和CuCl22H2O的部分实验步骤如图:
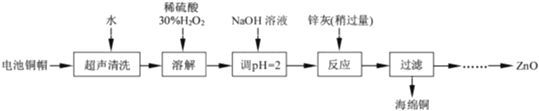
(1)从“滤液Ⅰ”中提取ZnCl24H2O的实验步骤依次为_____、_____、过滤、冰水洗涤、低温干燥
(2)“溶解Ⅱ”步骤中,发生反应的离子方程式为_____
(3)氯化铜溶液中各含铜物种的分布分数与c(Cl﹣)的关系如图。
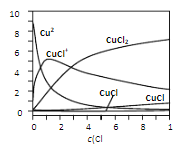
①当c(Cl﹣)=9molL﹣1时,溶液中主要的3种含铜物种浓度大小关系为_____
②在c(Cl﹣)=1molL﹣1的氯化铜溶液中,滴入AgNO3溶液,生成白色沉淀的离子方程式为_____(任写一个)。
(4)为测定产品中“CuCl22H2O”的纯度,称取0.90g样品,溶于稀硫酸并配成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量的KI充分反应,再向其中逐滴加入0.02000 molL﹣1 Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液2500mL。已知:2Cu2++4I﹣=2CuI(白色)↓+I2;2S2O32﹣+I2═2I﹣+S4O62﹣
①样品配成溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要_____、_____
②请依据实验数据计算样品中CuCl22H2O的质量分数(写出计算过程)______________
查看答案和解析>>
科目: 来源: 题型:
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=![]() ,它所对应的化学反应为:________________。
,它所对应的化学反应为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3 kJ/mol
CO2(g)+H2(g) △H=-41.3 kJ/mol
总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为 0.020 mol/L,在该条件下,CO的平衡转化率为:________________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如 NO、NO2、N2O4等,对反应N2O4(g)![]() 2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
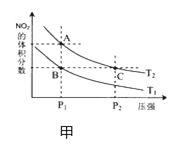
A. A、C 两点的反应速率:A>C
B. A、C 两点气体的颜色:A 深,C浅
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态 B 到状态 A,可以用加热的方法
E. A、C 两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3,25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加 n L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(NH3·H2O的电离平衡常数取Kb=2×10﹣5 mol/L)。
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图乙所示,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触。
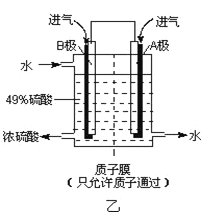
①溶液中H+的移动方向由________极到________极;(用 A、B 表示)
②B电极的电极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
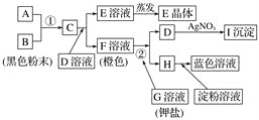
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
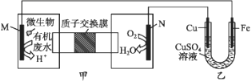
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-![]() 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+
C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
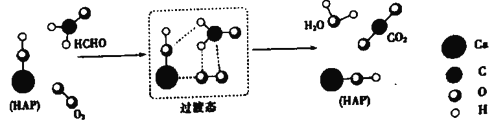
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
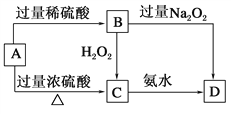
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com