
科目: 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反应N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
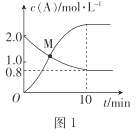
①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_______。
②M点时,N2H4的转化率为______(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡______(填“正向移动”“逆向移动”或“不移动”)。
(3)①在惰性气体中,将黄磷(P4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH2PO2,同时还产生磷化氢(PH3)气体,该反应的化学方程式为________________。
②次磷酸(H3PO2)是一元酸,常温下.1.0 mol●L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=___________。
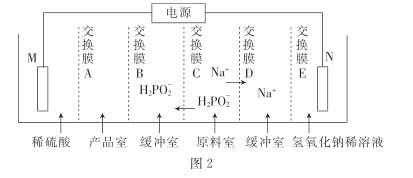
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于____(填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为______,当电路中流过3.8528×105库仑电量时.制得次磷酸的物质的量为_____ (一个电子的电量为 1.6×10- 19库仑,NA数值约为6. 02× 1023)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)硅酸盐可以改写成氧化物的形式,将下列硅酸盐改写成氧化物的形式:
①镁橄榄石(Mg2SiO4):____。
②高岭石[Al2(Si2O5)(OH)4]:____。
(2)写出下列反应的方程式:
①漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
②Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
③NO2与水反应的化学方程式为___________,该反应中氧化剂与还原剂的物质的量之比为_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是 ( )
①C(s)+O2(g)=CO2(g) △H1 、C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 、S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 、CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①NH3(g)+HCl(g)=NH4Cl(s) ΔH1=-176 kJ/mol
②NH3(g)  NH3(aq) ΔH2=-35.1 kJ/mol
NH3(aq) ΔH2=-35.1 kJ/mol
③HCl(g)  HCl(aq) ΔH3=-72.3 kJ/mol
HCl(aq) ΔH3=-72.3 kJ/mol
④NH3(aq)+HCl(aq) =NH4Cl(aq) ΔH4=-52.3 kJ/mol
则NH4Cl(s)  NH4Cl(aq)的反应热ΔH5(kJ/mol)为( )
NH4Cl(aq)的反应热ΔH5(kJ/mol)为( )
A. 16.3B. -16.3C. 335.7D. -335.7
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,Q的核电荷数是X与Z的核电荷数之和, E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为___________、____________;
(2)XZ2与YZ2分子的立体结构分别是___________和___________,在水中溶解度较大的是________(填化学式);
(3)Q元素的价电子排布图为___________,在形成化合物时它的最高化合价为_____;
(4)Z与E形成的化合物中,各原子最外层都达到8电子结构,该化合物中心原子采用的轨道杂化方式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______。
(3)若产生相同物质的量的氢气,反应所需钠、铁、铝的质量比是____________。
(4)若产生相同体积(同温、同压)的氢气,反应所需钠、铁、铝三种金属的物质的量之比是____。
(5)分别取金属钠、铁、铝0.2 mol,分别投入10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气的体积大小的顺序是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是元素周期表的简略框架图。
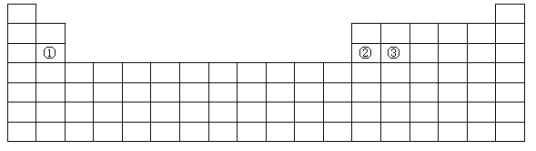
(1)在第2~5周期,处于金属元素与非金属元素分界线附近的非金属元素依次是____(填元素符号)。
(2)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中______族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实______________________。
(3)比较上表中元素①与元素②的下列性质(填写“>”或“<”)。电负性:①_____②;第一电离能:①____________②。
(4)某短周期元素最高正价为+7,其原子结构示意图为__________________。
(5)基态原子③中,电子占据的最高能层符号_____,该能层具有的原子轨道数为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1b.+29.7 mol·L-1
c.-20.6 mol·L-1d.-241.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新科技之一的碳呼吸电池,电池原理如下图所示,已知草酸铝[Al2(C2O4)3]难溶于水,则下列说法正确的是

A. 该装置将电能转变为化学能
B. 正极的电极反应为C2O42--2e- =2CO2
C. 每生成 1 mol Al2(C2O4)3,有 6 mol 电子流过负载
D. 随着反应的进行草酸盐浓度不断减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com