
科目: 来源: 题型:
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。

①在0~5min内A容器中v(CH3OH)=___;该温度下上述反应的平衡常数K=___(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___(填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】在150℃时碳酸铵可以受热完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
查看答案和解析>>
科目: 来源: 题型:
【题目】某干燥粉末可能由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种组成。将该粉末与足量的盐酸反应有气体
中的一种或几种组成。将该粉末与足量的盐酸反应有气体![]() 逸出,
逸出,![]() 通过足量的
通过足量的![]() 溶液后体积缩小(同温、同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
溶液后体积缩小(同温、同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有![]() 、
、![]() 、
、![]() , ②粉末中一定不含
, ②粉末中一定不含![]() 和
和![]()
③粉末中一定不含有![]() 和
和![]() ④无法肯定粉末中是否含有
④无法肯定粉末中是否含有![]() 和
和![]()
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低
D. 需用托盘天平称量的NaClO固体的质量为148.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1;途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1;2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1;2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
II、利用如图所示装置测定中和热的实验步骤如下:
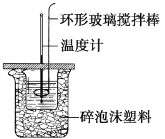
①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.1 | 20.1 | 24.2 |
4 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=____kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫的污染臭名昭著,含硒的化学药物却有望迎来美名。某环保车间将含SO2、NO烟气经O3预处理后用CaSO3水悬浮液吸收。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)实验表明,在常温下反应:3NO(g)+O3(g)=3NO2(g)正向自发,试说明原因:_____。
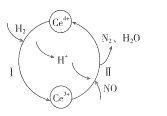
(2)将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示,试写出反应I的离子反应方程式:___________,反应II的离子方程式:________________。
(3)用CaSO3水悬浮液处理二氧化氮,若在吸收液中加入Na2SO4溶液,能提高NO2的吸收速率,其主要原因是___________;达到平衡后,溶液中c(SO32-)=__________[用c(SO42-、Ksp(CaSO3)和Ksp(CaSO4)表示]。
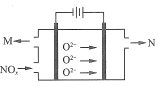
(4)氮的氧化物还可以通过电解法处理获得氮气和氧气,电解质为固体氧化物陶瓷,据图写出阴极的电极反应方程式:_______________。
(5)已知 SeO2与SO2的混合烟气用水吸收可制得单质硒,过滤得粗硒,硒的部分物理性质如下表所示。某工艺采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_____。

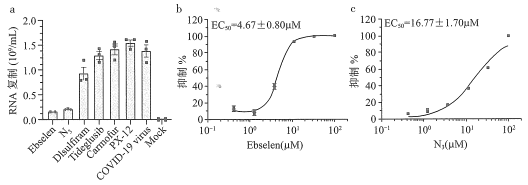
(6)最近我国学者锁定COVID-19的新靶点Mpro蛋白酶,通过先进筛选手段,在FDA批准的已上市和临床实验药物中,发现老药Ebselen(![]() )在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________
)在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________![]() ,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。
,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
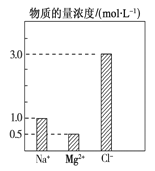
A. NaCl的物质的量为0.1mol
B. 该混合液中BaCl2的物质的量为0.05mol
C. 溶质MgCl2的质量为9.5 g
D. 将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是_________(填选项序号)。
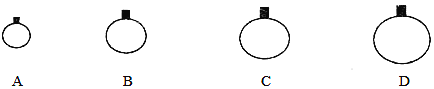
(2)在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的某植物营养液中,c(K+)=0.7molL﹣1,c(Zn2+)=0.1molL﹣1,c(Cl﹣)=0.3molL﹣1,向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为_________。
(4)0.3mol的甲烷与_________g氨气中所含氢原子数相等。
(5)在同温同压下,2g二氧化碳的体积为120ml,而2gA气体的体积为165ml,则气体A的摩尔质量_________________;
(6)标准状况下,11.2L二氧化碳和一氧化碳混合气体的质量为18g,则其中二氧化碳的质量为_________,一氧化碳的体积为_________。
(7)氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100molL﹣1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl﹣,则S2O32﹣将转化成____________。
A.S2﹣ B.S C.SO32﹣ D.SO42﹣
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7+14HCl(浓)=3Cl2↑+2CrCl3+2KCl+7H2O,若反应中转移0.6mole﹣,则被氧化的HCl的物质的量为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com