
科目: 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。表列出了有关物质的部分物理性质,请回答:
)等产品。表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
 (1)装置a的名称是______________。
(1)装置a的名称是______________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________。
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_____________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过_____、_____(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_____。(苯甲酸相对分子质量:122.0)
查看答案和解析>>
科目: 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1)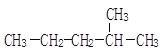 __________;
__________;
(2) ____________;
____________;
(3)![]() ___________;
___________;
(4)![]() ____________;
____________;
(5)2,6-二甲基-4-乙基辛烷_______;
(6)2-甲基-1-戊烯____________;
(7)3-甲基-1-丁炔:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(1)已知:H2SeO3为二元弱酸,Ka1(H2SeO3)=3.5×10-3,Ka2(H2SeO3)=5.0×10-8。用离子交换树脂处理含Na2SeO3浓度较高的废水时,发生的交换反应为SeO32-+2RCl=R2SeO3+2Cl- (R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将________(填“增大”“减小”或“不变”)。
(2)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。
①以木屑和FeCl3·6H2O为原料,在N2氛围中迅速升温至600 ℃,保持2 h,过程中木屑先转化为木炭,最终制得木炭包覆纳米零价铁。制备木炭包覆纳米零价铁过程中,木炭的作用有吸附和________________________________________。
②木炭包覆纳米零价铁在碱性废水中形成许多微电池,加速SeO32-的还原过程。SeO32-在微电池正极上转化为单质Se,其电极反应式为________。
(3) 绿锈[FeaⅡFebⅡ(OH)cXd](X代表阴离子,Ⅱ、Ⅲ表示铁元素的价态)中铁元素以结构态和游离态两种形式存在。由于结构态的双金属氢氧化物层间存在较大的空隙,形成了巨大的比表面积,同时结构态的FeⅡ还原能力优于游离态的FeⅡ,使得绿锈成为一种良好的除硒剂。
①结构态的绿锈具有优异的吸附性能,而且游离态的Fe3+还易水解生成Fe(OH)3胶体进一步吸附SeO32-。写出Fe3+水解的离子方程式:________。
②不同FeⅡ/FeⅢ组成的绿锈对SeO32-去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是________。
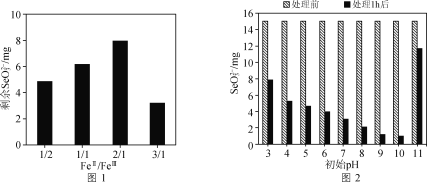
③废水的初始pH会对绿锈去除SeO32-的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO32-的去除效果突然迅速减小的原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某有机物的结构表示为![]() ,其名称是________________________。
,其名称是________________________。
(2)写出下列反应的化学方程式:
①草酸能使酸性高锰酸钾溶液褪色:____________________________________。
②把浓硝酸、浓硫酸和甲苯混合加热制备TNT:______________________________。
③溴乙烷在一定条件下发生消去反应:__________________________________。
(3)某烃A分子中碳的质量分数为90.57%,在某温度下V L该烃的蒸气质量是相同状况下V L H2质量的53倍,则烃A的分子式为______________;若烃A分子中含有苯环,且苯环上的一氯代物只有一种,则A的结构简式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
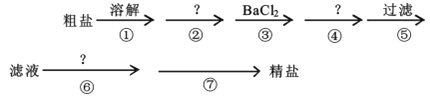
(1)④步所加试剂是___。
(2)第⑥步发生反应的离子方程式为___、___。
(3)第⑦步的操作名称___,需要的玻璃仪器有___、___。
(4)通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物是药物生产的中间体, 其结构简式如下图,下列有关叙述不正确的是
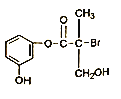
A. 该有机物与浓溴水可发生取代反应
B. 该有机物与浓硫酸混合共热可发生消去反应
C. 1mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH
D. 该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以NaClO3、H2SO4、SO2、H2O2和NaOH为原料,制备NaClO2和无水Na2SO4,其主要流程如下:

已知:① 2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O;
② 2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③温度高于60 ℃时,NaClO2发生分解生成NaClO3和NaCl。
(1)反应1中SO2与NaClO3反应制得ClO2气体,该反应的化学方程式为________。
(2)在图1所示装置中发生反应2生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时吸收液中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是____________________________________________________。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3 ℃进行,实验中可采取的措施是______________________。
③装置Ⅱ的作用是________________________。

(3) 母液2经过减压蒸发、冷却结晶等操作获得NaClO2粗产品。实验中采用减压蒸发的原因是________________________________________________。
(4) Na2SO4的溶解度曲线如图2所示。请补充完整由母液1制备无水Na2SO4的实验方案:______________________________________________________________,用无水乙醇洗涤,干燥得到产品。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )
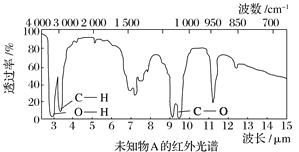
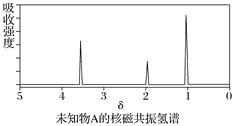
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目: 来源: 题型:
【题目】矿业废水中Al3+含量的测定和处理是环境保护的重要课题。
(1)向矿业废水中加入NaOH溶液至沉淀不再溶解,再加入一定量的NaHCO3溶液搅拌,反应生成丝钠铝石[NaAl(OH)2CO3]沉淀,过滤除去。写出加入NaHCO3溶液生成丝钠铝石沉淀的离子方程式:____________________________________。
(2) 为确定加入NaHCO3溶液的量,需测定矿业废水中Al3+的含量。工业上常采用EDTA络合滴定法,步骤如下:
步骤1:CuSO4标准液的配制与标定。取一定量胆矾溶于水,加入适量稀H2SO4,转移到1 L容量瓶中定容。准确量取25.00 mL所配溶液置于250 mL锥形瓶中,用0.005 0 mol·L-1EDTA标准液滴定至终点。重复3次实验,平均消耗EDTA标准液10.00 mL 。
步骤2:样品分析。取10.00 mL矿业废水置于250 mL锥形瓶中,加入一定体积柠檬酸,煮沸;再加入0.005 0 mol·L-1的EDTA标准液20.00 mL,调节溶液pH至4.0,加热;冷却后用CuSO4标准液滴定至终点,消耗CuSO4标准液30.00 mL。(已知:Cu2+、Al3+与EDTA反应的化学计量比均为1∶1)
步骤1中,重复3次实验的目的是____________________________。
② Fe3+也可与EDTA反应,步骤2中加入的柠檬酸是作为掩蔽剂,消除Fe3+的干扰。若该矿业废水样品中含有Fe3+,而上述实验中未加入柠檬酸,则测定的Al3+含量将________(填“偏大”“偏小”或“无影响”)。
③计算该矿业废水中Al3+的含量____________(用mg·L-1表示)(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要480mL1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有____。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是____(填操作序号)。
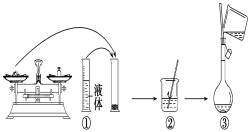

(3)称取NaOH固体时,所需砝码的质量为____(填写字母)。
A. 19.2g B. 20g C. 19.2g ~20g D. 大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号)___ 。
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是____。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量水滴
(6)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com