
科目: 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
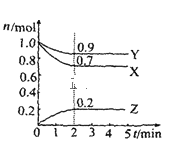
(1)该反应的化学方程式为:______。
(2)反应开始至2min,用Z表示的平均反应速率为:______。
(3)下列叙述能说明上述反应达到化学平衡状态的是______(填序号):
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amolX(g)和bmolY(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:_____ ②恒容通入氦气:_____③使用催化剂:______
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g) 在5 L的密闭容器中进行反应,30 min后,C的物质的量增加了 0.30 mol。下列叙述正确的是( )
4C(g)+6D(g) 在5 L的密闭容器中进行反应,30 min后,C的物质的量增加了 0.30 mol。下列叙述正确的是( )
A. 30 min中A的平均反应速率是0.010 mol·L-1·min-1
B. 容器中D的物质的量一定增加了0.45 mol
C. 容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加0.30 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用NaCl固体配制100mL2.0mol·L1NaCl溶液,请回答下列问题。
(1)用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和__。
(2)用托盘天平称取NaCl固体的质量是__g。
(3)下列情况中,会使所配溶液浓度偏高的是__(填字母)。
A.定容时,俯视刻度线 B.转移液体时,有少量液体洒出
C.加蒸馏水超过了刻度线 D.没有洗涤烧杯和玻璃棒
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
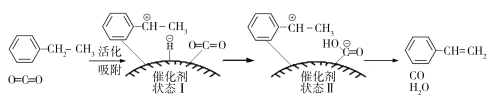
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________________________。
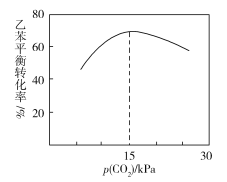
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上冶炼铁的原理为:Fe2O3 +3CO![]() 2Fe+ 3CO2。
2Fe+ 3CO2。
(1)该反应中氧化剂是__(填化学式),碳元素被__(填“氧化”或“还原”)。
(2)若消耗了3molCO,则生成CO2的体积是__L(标准状况),转移电子的物质的量是___mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.常温常压下,14gN2含有的分子数约为3.01×1023
B.64gSO2含有的氧原子数约为6.02×1023
C.标准状况下,22.4LH2O含有的分子数约为6.02×1023
D.2L0.5molL1MgCl2溶液中,含有的Cl-数约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
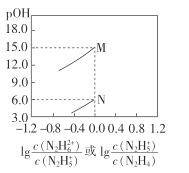
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2 O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2 O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g) △H4
则△H4的正确表达式为( )
A.△H4=3/2(△H1-△H2-3△H3)B.△H4=2/3 (3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)D.△H4=2/3 (△H1+△H2-3△H3)
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
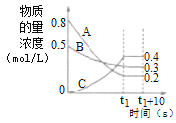
A.该反应的化学方程式为A(g)+3B(g)2C(g)
B.(t1+10)s时,升高温度,正、逆反应速率加快
C.在t1s时,V正(A)=0
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com