
科目: 来源: 题型:
【题目】对于相同温度、相同压强下,相同物质的量的SO2和SO3,下列说法中正确的是( )
A.硫元素的质量比为5:4B.质量之比为1:1
C.分子数之比为5:4D.密度之比为4:5
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象不能充分说明相应的化学反应是放热反应的是
选项 | A | B | C | D |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲侧液面低于乙侧液面 | 温度计的水银柱上升 | 反应开始后,气球慢慢胀大 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为0.1 molL-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )

A.Ka(HA)=10-6B.b点时,c(B+)+c(HA)=0.05mol/L
C.c点时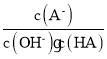 随温度升高而增大D.a→c过程中水的电离程度始终增大
随温度升高而增大D.a→c过程中水的电离程度始终增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺做实验,流程如下:
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)验证溶液B中是否含有Fe3+的方法:_______________________________。
(3)不溶物A是_____(填化学式),写出③中D→E反应的离子方程式_____________________________。
(4)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O、Fe3++3OH﹣=Fe(OH)3↓还有______________________________。
(5)如果铝土矿10g,步骤④中灼烧后得不溶物G质量为5.1g,则矿石中铝元素的含量为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是5种元素的相关信息,W、X都位于第三周期。
元素 | 信息 |
Q | 地壳中含量最高的元素 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色试验(透过蓝色钴玻璃)火焰呈紫色 |
Z | 原子结构示意图为: |
(1)Q在周期表中的位置是__。
(2)W的最高价氧化物对应的水化物的化学式是___。
(3)X单质与水反应的离子方程式是__。
(4)金属性Y强于X,用原子结构解释原因:__,失电子能力Y大于X,金属性Y强于X。
(5)下列对于Z及其化合物的推断中,正确的是__(填字母)。
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。
查看答案和解析>>
科目: 来源: 题型:
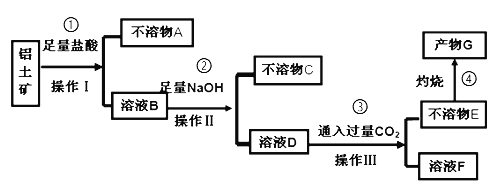
【题目】现在污水治理越来越引起人们重视。可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() )同时利用此装置的电能在铁上镀铜,下列说法不正确的是( )
)同时利用此装置的电能在铁上镀铜,下列说法不正确的是( )
A.A极的电极反应式为![]() +e-=Cl-+
+e-=Cl-+![]()
B.当乙中铜电极质量减少6.4g,甲中A极区增加的日的个数为0.1NA
C.膜电池不适合在较高温度环境下工作
D.反应过程中乙中电解质溶液c(Cu2+)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2等)为原料制备NixOy和碳酸钻的工艺流程如下:
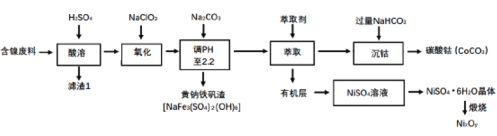
(1)“酸溶”时需将含镍废料粉碎,目的是___;含有CoCO3的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为____。
(2)“氧化”中添加NaClO3的作用是____,为证明添加NaClO3已足量,可用____ (写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀(NaFe3(SO4)2(OH)6),其离子方程式为_____。
(4)“沉钴”过程的离子方程式__。若“沉钴钻”开始时c(Co2+)=0.10 mol/L,则控制pH≤__时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)。
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,_____,过滤,洗涤,干燥。“锻烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物(NixOy)的化学式为____。

查看答案和解析>>
科目: 来源: 题型:
【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__。
(3)①甲同学认为:实验Ⅱ观察到__现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先③步骤步骤,,,,,加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是__。
(4)综合实验Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:

已知:醛基在一定条件下可以还原成甲基。回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为______,A与新制氢氧化铜悬浊液反应的化学方程式为_______。
(2)C的结构简式为________,D与E之间的关系为_______。
(3)反应⑦的反应类型为_______;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为____。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有______种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为_________。
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_________(用箭头表示转化关系,箭头上注明试剂)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com