
科目: 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是 ( )
A. 室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小
B. 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
C. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
D. 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示:

图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)写出下列物质的化学式X_________,C_________,F_________,G__________。
(2)写出下列反应的化学方程式
①_____________________________________________。
②______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】天然脑砂含少量NH4Cl,《唐本草》记载脑砂入药可以散瘀消肿。某学习小组设计下列步骤制取NH4Cl,并进行天然脑砂含量的测定。请回答相关问题:
步骤Ⅰ用氨气与适量氯气反应制取NH4Cl
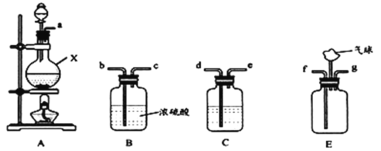
(1)装置A中仪器X的名称为___;若用浓盐酸与MnO2反应制取氯气,则该反应的离子方程式为___。
(2)C中盛放的试剂是___;要得到干燥纯净的氯气,按照气流由左到右的顺序,上述A、B、C装置连接依次为a→___(用小写字母表示)。
(3)氨气与适量氯气混合反应可生成NH4Cl和一种无污染的气体,利用E装置模拟该反应。氨气应从___(用小写字母表示)通入,反应的化学方程式为___;观察到的现象是___。
步骤Ⅱ天然脑砂中NH4Cl含量的测定
准确称取一定质量脑砂,与足量的氧化铜混合,如图所示进行实验。
已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
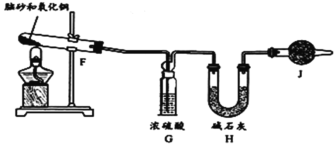
(4)为完成NH4Cl含量的测定,请完成下列实验步骤:
加热前,称量H装置的总质量;当观察到___现象时,停止加热,冷却,___。
(5)如果不用J装置,测出NH4Cl的含量将___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的价电子排布式为___。
(2)磷的一种同素异形体——白磷(P4)的空间构型为___,其键角为__,推测其在CS2中的溶解度___(填“大于”或“小于”)在水中的溶解度。
(3)膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试用价层电子对互斥理论分析PH3的键角小于NH3的原因:___。
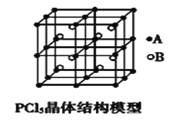
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A、B的化学式分别为___、__,A的中心原子杂化轨道类型为___。
(5)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素是__(填元素符号)。
(6)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如下表所示。试从结构的角度分析它们熔点不同的原因:__。
物质 | BN | AlN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0℃、101 kPa条件下的H2体积为44.8 mL),下列说法不正确的是
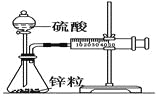
A. 用锌粒表示10 s内该反应的速率为0.013 g·s-1
B. 忽略锥形瓶溶液体积的变化,用H+来表示10 s内该反应的速率0.01 mol·(L·s)-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol·(L·s)-1
D. 用H2表示10 s内该反应的速率为0.004 mol·(L·s)-1
查看答案和解析>>
科目: 来源: 题型:
【题目】现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的还原产物,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题:
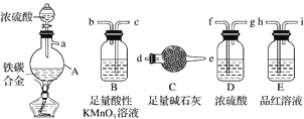
(1)该装置的连接顺序a___(填接口字母),连接好装置后,首先应进行的操作是____。
(2)mg铁碳合金中加入浓H2SO4,点燃酒精灯一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:A:只含有Fe3+;B:只含有Fe2+;C:____,若为A,则A中反应的化学方程式为___,验证C种可能的实验方法___。
(3)待A中不再逸出气体时,停止加热,拆下C并称重,C增重bg。铁碳合金中铁的质量分数____(写表达式)。
(4)某同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:_____。
(5)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:
①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0kJ·mol1
CO2(g)+NO(g) ΔH1=234.0kJ·mol1
②4NO(g)![]() 2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
反应③2NO2(g)+4CO(g)![]() N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___(填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___。
A.CO的反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=__(保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡__移动(填“正向”、“逆向”或“不”)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。
①CH4还原NO2反应的化学方程式为___。
②在相同条件下,选用A、B、C三种不同催化剂进行反应,生成N2的物质的量与时间变化如图图1所示,其中活化能最大的是___[Ea(A)、Ea(B)、Ea(C)分别表示三种催化剂下该反应的活化能]。
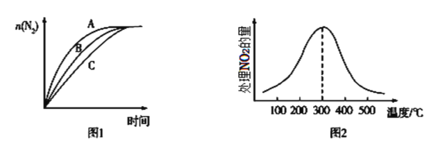
③在催化剂A作用下,测得相同时间内处理NO2的量与温度的关系如图2所示,曲线先增大后减小的可能原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=C+D中产物D的浓度随时间变化的关系如图。则下列有关说法正确的是
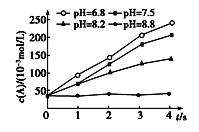
A. pH=8.8时,升高温度,反应速率不变
B. 保持外界条件不变,反应一段时间后,pH越小,D的浓度越大
C. 为了实验取样,可以采用调节pH的方法迅速停止反应
D. 减小外界压强,反应速率一定减小
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:
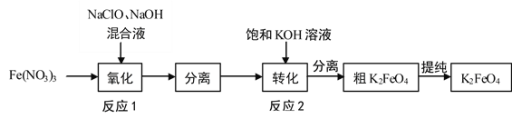
①Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为___(填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是__。
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为___;理论上每制备0.5mol的Na2FeO4消耗NaClO的质量为___(保留小数点后1位)。
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为__。电解后,阴极室得到的A溶液中溶质的主要成分为___(填化学式)。
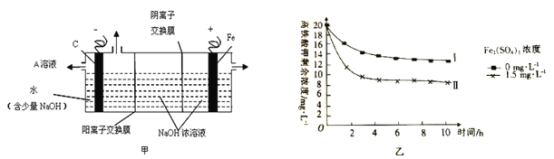
(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是_____(填字母)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(2)将320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过________(填操作名称)、干燥后,得到固体2.33 g,气体N与溴水反应的化学方程式为______________________,计算推知气体N中SO2的体积分数为________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是________,理由是_______________________________(用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是________________(填字母) ,其中A的作用是_______________,B中试剂X的化学式是________。
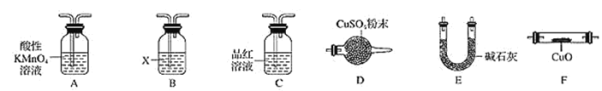
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com