
科目: 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
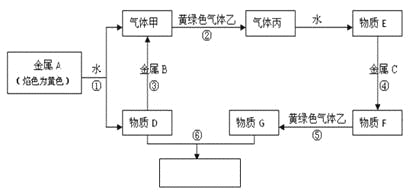
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A、______B、______C、________乙__________
(2)写出下列反应化学方程式:
反应①___________________________________
反应③___________________________________
(3)写出下列反应离子方程式:
反应④___________________________________
反应⑥___________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用![]() 和氨水的混合液浸取废铜矿渣中的单质铜,得到
和氨水的混合液浸取废铜矿渣中的单质铜,得到![]() 。某小组同学欲通过实验探究其原理。
。某小组同学欲通过实验探究其原理。
(查阅资料)i.![]() 呈深蓝色,
呈深蓝色,![]() ;受热易分解,放出氨气。
;受热易分解,放出氨气。
ii.![]() 在水溶液中不稳定,
在水溶液中不稳定,![]() 在溶液中只能以
在溶液中只能以![]() 等络合离子的形式稳定存在;
等络合离子的形式稳定存在;![]() 无色,易被氧气氧化为
无色,易被氧气氧化为![]() 。
。
(实验1)制备![]() 。
。
向盛有![]() 溶液的试管中滴加
溶液的试管中滴加![]() 氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到
氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到![]() 晶体。
晶体。
(1)资料表明,向![]() 溶液中滴加氨水,可能会生成浅蓝色
溶液中滴加氨水,可能会生成浅蓝色![]() 沉淀。
沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,____________(补全实验操作和现象),证明沉淀中含有![]() 。
。
②补全实验1中生成![]() 沉淀的离子方程式:
沉淀的离子方程式:
![]() ____________+
____________+![]() ____________
____________
(2)甲同学设计实验证明深蓝色溶液中含![]() :加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
(实验2)探究用![]() 和氨水的混合液浸取单质铜得到
和氨水的混合液浸取单质铜得到![]() 的原理。
的原理。
编号 | 实验装置及部分操作 | 烧杯中溶液 | 实验现象 |
2-1 |
实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验, 10 min内记录甲烧杯中现象 | 甲: 乙: | 电压表指针迅速偏转至0.1V;甲中溶液无明显变化 |
2-2 | 甲: 乙: | 电压表指针迅速偏转至0.3V;甲中溶液无明显变化 | |
2-3 | 甲: 乙:溶液A | 电压表指针迅速偏转至0.35V;甲中溶液无明显变化 | |
2-4 | 甲: 乙: | 电压表指针迅速编转至0.65V;几分钟后,甲烧杯溶液逐渐由无色变蓝色 |
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大
(3)溶液A为____________。
(4)对比实验2-1和2-2,可以得到结论是____________。
(5)实验2-4中,甲烧杯中溶液由无色变为蓝色的原因是____________。
(6)依据上述实验,分析用![]() 和氨水的混合液浸取单质铜的原理:____________。
和氨水的混合液浸取单质铜的原理:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在12g某二价金属的硫酸盐中,含有0 4mol氧原子,此硫酸盐的摩尔质量为_________g/mol。
(2)质量分数为49%的硫酸溶液,密度为1.8g/cm3,则物质的量浓度为__________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为_____________________
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。

这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
_________接__________ ,________接__________,___________ 接_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
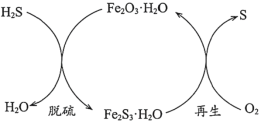
①下列说法正确的是____________(填序号)。
a.单质硫为淡黄色固体
b.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_______。
(2)电化学溶解一沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
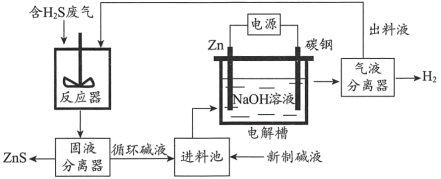
已知: Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
①锌棒连接直流电源的____________(填“正极”或“负极”)。
②反应器中反应的离子方程式为____________。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:___________。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii.将带有沉淀的滤纸加入盛有15mL 0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii.用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是____________。
②滴定终点的现象是__________________。
③若消耗Na2S2O3标准液的体积为20mL,则煤气中![]() 的含量为_______________mg/m3。
的含量为_______________mg/m3。
查看答案和解析>>
科目: 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某实验需要1mol/LNaOH溶液500mL。配制该溶液所需要的玻璃仪器有烧杯、玻璃棒、__________和 __________。
配制实验操作步骤有:
a.在天平上称量NaOH固体,加水溶解,冷却至室温。
b.把制得的溶液小心地注入一定容积容量瓶中。
c.继续向容量瓶中加水至距刻度线lcm2cm处,改用胶头滴管加水至刻度线。
d.用少量水洗涤烧杯和玻璃棒23次,每次将洗涤液转入容量瓶,并摇匀。
e.将容量瓶塞塞紧,充分摇匀。填写下列空白:
(2)操作步骤和正确顺序为_______________________。
(3)该配制过程中两次用到玻璃棒,其作用分别是_________,___________。
(4)定容时,若俯视刻度线,会使结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到化学平衡状态的标志是
2Z(g)达到化学平衡状态的标志是
A.Z的生成速率和X的分解速率相等
B.单位时间内生成nmolX,同时生成了3nmolY
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子个数之比为1∶3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01 mol HCl气体 | 加入0.01 mol NaOH固体 | |
i.1 L H2O | 7 | a | 12 |
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液 | 4.76 | 4.67 | 4.85 |
①a=____________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:____________。
③试剂ii中微粒浓度关系正确的有____________(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是____________(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
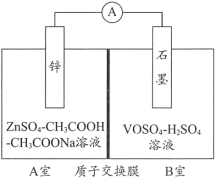
Zn+2VOSO4+2H2SO4![]() ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)____________(填“增大”“减小”或“不变”),结合化学用语说明理由:______。
②充电时,A室中的c(H+)变化缓慢的原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在C(s)+CO2(g)![]() 2CO(g)反应中,可使反应速率增大的措施是
2CO(g)反应中,可使反应速率增大的措施是
①压缩容器体积 ②增加炭的量 ③恒容下通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升高温度
A.①③⑥B.②④⑥C.①③④D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com