
科目: 来源: 题型:
【题目】某化学研究性学习小组将高锰酸钾粉末与一定量铁粉混合隔绝空气加热,并在实验结束后对所得产物中不溶于水的黑色粉末X进行探究。
(探究目的)分析黑色粉末X的组成,并进行相关实验。
(猜想与假设)该黑色粉末可能含有铁粉、二氧化锰、四氧化三铁中的一种或几种。
(初步认证)将磁铁靠近黑色粉末,部分被吸引。
(初步结论)黑色粉末中_______含有MnO2,;_______含有Fe;________含有Fe3O4(填“一定”、“可能”或“一定不”)。
(定性检验)
实验步骤 | 实验操作 | 实验现象 |
步骤一 | 取少量黑色粉末于试管中,加足量稀硫酸,微热 | 黑色粉末部分溶解,无气泡产生 |
步骤二 | 将步骤一反应后试管中的物质过滤,向滤液中滴加几滴KSCN 溶液,振荡 | 溶液呈现红色 |
步骤三 | 取步骤二所得滤渣于试管中,加足量浓盐酸,加热 | 滤渣全部溶解,有黄绿色气体产生 |
步骤三中产生气体的离子方程式为___________________________________________。
(定量检验)
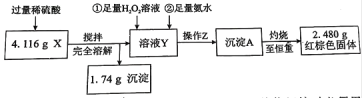
①操作Z的名称是__________,下图的仪器中,在灼烧沉淀时必须用到的是____________(填字母)。
②有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示)__________________________________________。
③通过以上数据,得出4.116 g黑色粉末X中各成分的物质的量为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人们每天都要摄入大量的淀粉类物质,以维持机体的营养均衡。这是因为淀粉[化学式为(C6H10O5)n]在淀粉酶作用下或在酸性环境下可以水解成葡萄糖[化学式是C6H12O6],请计算:
(1)淀粉的摩尔质量为______________;
(2)将90 g葡萄糖溶于水,配成1 L溶液,所得溶液溶质的物质的量浓度为______________;
(3)把淀粉溶于沸水中,制成淀粉溶液,回答下列问题。
①如何通过实验证明淀粉溶液是胶体:______________(填现象名称)。
②在淀粉溶液中加入少量氯化钠晶体,并装入半透膜袋,系紧袋口,把它悬挂在盛有蒸镏水的烧杯里充分反应。能从半透膜里析出的分散质的化学式是____________,该操作的名称是____________。
(4)下列描述的分别是胶体的性质或现象,请按要求填空:
①江河入海口三角洲的形成,这是发生了胶体的_________;
②在土壤上施用含氮量相同的碳酸氢铵和硝酸铵肥料,碳酸氢铵肥效高,这是因为_________________________________。
③用含0.1 mol FeCl3的饱和 FeCl3溶液制Fe(OH)3胶体时,形成胶体粒子数目小于0.1 NA,这是因为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A.ΔH4﹦2ΔH32ΔH2ΔH1
B.O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C.1 mol O2(g)和 2 mol H2(g)具有的总能量高于 2 mol H2O(g)
D.联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是一种常用氧化剂,主要用于化工、防腐及制药工业等。可将软锰矿(主要成分为MnO2)和KClO3在碱性介质中制得K2MnO4,然后通入CO2制备高锰酸钾。已知:
温度 | 溶解度/g | ||||
K2CO3 | KHCO3 | KMnO4 | K2SO4 | CH3COOK | |
20℃ | 111 | 33.7 | 6.38 | 11.1 | 217 |
(1)制备锰酸钾的主要反应为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
①该反应中的氧化剂是_____________,还原剂是_____________。
②每生成 1mol K2MnO4转移_______ mol 电子。
(2)通入少量CO2气体时,锰酸钾发生歧化反应,生成KMnO4,MnO2,K2CO3。
①则生成的 KMnO4与MnO2的物质的量之比为__________。
②若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是______________________________,可以把通CO2改为加其他的酸。从理论上分析,选用下列酸中_______,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能( )
A. H2SO4 B. NaOH C. AgNO3 D. Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列说法正确的是
Na2S+2CO2↑。下列说法正确的是
A.4.2g14C原子含中子数目为1.8NA
B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C.该反应中,若生成1mol氧化产物,转移电子数目为4NA
D.常温下2.24LCO2中共用电子对数目为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铵铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
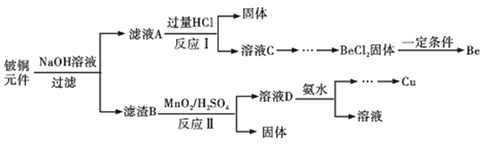
已知:
Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13
(1)滤渣B的主要成分为______(填化学式);
(2)写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式______;
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式______,若用浓HNO3溶解金属硫化物缺点是______(任写一条);
(4)从BeCl2溶液中得到BeCl2固体的操作是______。
(5)溶液D中含c(Cu2+)=2.2molL-1、c(Fe3+)=0.008molL-1、c(Mn2+)=0.01molL-1,逐滴加入稀氨水调节pH可依次分离首先沉淀的是______(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于______;
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种芳香酯类物质,也是一种重要的香料,工业上合成它的一种方法如下图所示。图中D的相对分子质量为106,D、E的核磁共振氢谱均只有两个峰,B经过氧化可以得到C。

已知:![]() R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
(1)A的结构简式为___________________________,D的名称是___________________。
(2)D→E的反应类型为_______________,“一定条件”的内容是__________________。
(3)B中官能团的名称是__________,G的结构简式为___________________________。
(4)E→F的化学方程式为_________________。
(5)符合下列条件的F的同分异构体共有________种,写出一种核磁共振氢谱有5个峰的同分异构体的结构简式:________________________________。
①遇FeCl3溶液能发生显色反应 ②含有醚键
(6)写出以乙烯为原料合成HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是一种高效的抗疟药,某研究性学习小组的同学通过查阅资料获得如下信息:青蒿素是由碳、氢、氧三种元素所组成的,熔点为156~157℃,他们设计了如下装置来测量青蒿素的分子组成,回答下列问题:
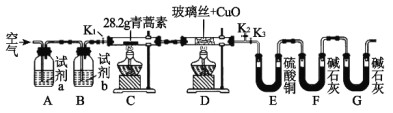
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
(1)试剂加入后首先要进行的操作是_____________,其目的是____________,实验中需要对开关K1、K2、K3进行操作,首次对开关K1、K2、K3进行操作的方法是________,适当时间后再关闭相应的开关,为提高实验的准确性,在C处停止加热后还应进行的操作是____________。
(2)试剂a、b分别是________________________________________,点燃C、D处酒精灯的先后顺序是___________________________,使用装置D的目的是___________。
(3)E中使用硫酸铜相对于使用CaCl2的好处(不考虑吸收效果的差异性)是_____。
(4)充分反应后获得的有关数据如上表(假设生成的气体全部被吸收):则测得青蒿素的最简式是_________________________。
(5)若要求出青蒿素的分子式,还需要通过实验测量出一个数据,请你指出该数据是什么,测量出该数据的方法是(只考虑理论上的可能性):___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.Cl2 +H2O![]() HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
B.CO2(aq)![]() CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
C.I2(g)+H2(g) ![]() 2HI(g)的平衡体系,加压后颜色变深
2HI(g)的平衡体系,加压后颜色变深
D.2NO2(g)![]() N2O4(aq)加压后颜色先变深后变浅
N2O4(aq)加压后颜色先变深后变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com