
科目: 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中进行反应:N2+3H2![]() 2NH3。该反应达到平衡的标志是
2NH3。该反应达到平衡的标志是
A.3v(H2)正=2v(NH3)逆B.单位时间生成m mol N2的同时生成3m mol H2
C.混合气体的密度不再随时间变化D.容器内的总压强不再随时间而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目: 来源: 题型:
【题目】黑色粉末A,黄色粉末B,它们都是单质,按下图进行实验:
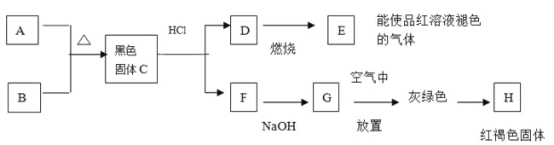
(1) 试根据上述反应现象推断以下物质的化学式:
A D E H
(2)写出C+盐酸![]() D+F的离子方程式:
D+F的离子方程式:
(3)写出D![]() E的化学方程式:
E的化学方程式:
(4)写出G![]() H的化学方程式:
H的化学方程式:
查看答案和解析>>
科目: 来源: 题型:
【题目】有一块铝铁合金,加入到足量氢氧化钠溶液,滤出不溶物洗涤后再用一定量盐酸恰好完全溶解,继续在溶液中加入足量氨水,在空气中静置至红褐色沉淀不再增加为止,将沉淀滤出再灼烧至恒重,得到残留 固体的质量与原合金的质量相同,则:
(1)合金溶于足量氢氧化钠溶液所得溶液中含有的阴离子有______ 、_______ ;
(2)沉淀滤出再灼烧至恒重,得到残留固体的化学式为____________________;
(3)合金中铝的质量分数为__________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2KMnO4![]() K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是_____(填化学式),反应中若产生0.3mol的气体则有________mol的电子转移。
(2)a+b的最大值为________,a+b最小值为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Cl-、Br-、Fe2+、I-的还原性依次增强。现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示,请回答:
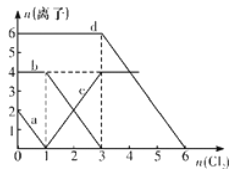
(1)a线分别代表溶液中____________的变化情况;
(2)c线分别代表溶液中____________的变化情况;
(3)原溶液中Br-与Fe2+的物质的量之比为____________;
查看答案和解析>>
科目: 来源: 题型:
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细![]() -氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
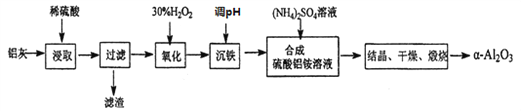
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。

(2)流程中加入H2O2 有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。己知:
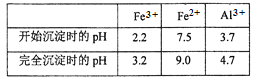
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为___________________________。
a.A12O3 b.NaOH c.Al(OH) 3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4 Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
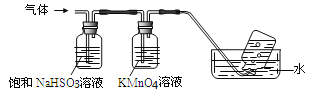
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com