
【题目】已知:2KMnO4![]() K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是_____(填化学式),反应中若产生0.3mol的气体则有________mol的电子转移。
(2)a+b的最大值为________,a+b最小值为________。
【答案】MnCl2 0.6 0.25 0.2
【解析】
(1)元素化合价降低发生还原反应得到还原产物;根据Cl元素化合价变化计算转移电子;
(2)KMnO4固体,加热一段时间后,收集到amol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体bmol氯气,根据电子转移守恒,整个过程中,Mn元素得到电子数等于O元素、Cl元素失去的电子,则有:0.1×(7-2)=4a+2b,整理得a+b=0.25-a,当高氯酸钾没有分解时,(a+b)达最大值,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,根据方程式计算氧气最大值,进而确定(a+b)的最小值。
(1)反应中Mn元素化合价由+7价变为+2价,化合价降低,得到电子,被还原,所以MnCl2是还原产物;产生0.3mol的氯气时,转移电子为n(e-)=0.3mol×2×[0-(-1)]=0.6mol;
(2)KMnO4固体加热一段时间后,收集到amol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到bmol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素失去的电子,则有:0.1×(7-2)=4a+2b,整理可得a+b=0.25-a,当高氯酸钾没有分解时,(a+b)达最大值,此时a=0,则(a+b)的最大值=0.25;当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4![]() K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.1mol×
K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.1mol×![]() =0.05mol,则a+b≥0.25-0.05=0.2,故(a+b)的最小值为0.2。
=0.05mol,则a+b≥0.25-0.05=0.2,故(a+b)的最小值为0.2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )

A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
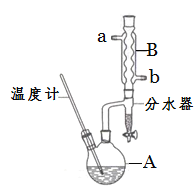
反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm—3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为_____________________________。
(2)加热A前,需先从________(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去_____,振摇后静置,粗产物应在分液漏斗的____口(填“上”或“下”)分离出。
(4)步骤④中最后一次水洗的作用为___________________________________。
(5)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右温度的馏分。
a. 100 ℃ b. 117 ℃ c. 135 ℃ d . 142 ℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满液体时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分是___________,下层液体的主要成分是_________。
(7)本实验中,正丁醚的产率为_________%。(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的 Fe、FeO、![]() 的混合物中,加入 100mL1mol/L 的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中,加入 KSCN 溶液无血红色出现。若用足量的 CO 在高温下还原 相同质量的混合物,能得到铁的质量为( )
的混合物中,加入 100mL1mol/L 的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中,加入 KSCN 溶液无血红色出现。若用足量的 CO 在高温下还原 相同质量的混合物,能得到铁的质量为( )
A.2.8gB.5.6gC.11.2gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是:____________,产物中单质B是________。
(2)②中所发生的各反应的化学方程式为____________________、________________。
(3)③中所发生的各反应的离子方程式为___________________、_____________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
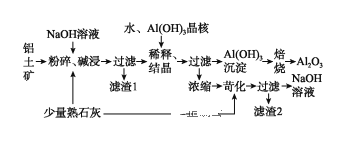
【题目】某铝土矿中主要含有Al2O3、Al(OH)3还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示:
请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是____________________。滤渣1的主要成分为________________。
(2)Al2O3与NaOH溶液反应的离子方程式为____________________________________。
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的_________气体的方法来代替。(已知:通入该气体后,其产物之一可用来做发酵粉)。
(4)焙烧过程中发生的化学方程式为_________________________________。
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:_________________________________________________。
(6)该生产流程能实现____________________(填化学式)的循环利用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾可用于制取钾肥和冶炼铝,具体工艺流程如下图所示:
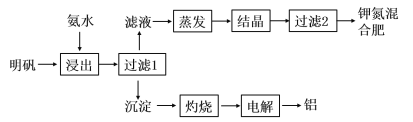
(1)“浸出”反应的离子方程式为__________________________________。“浸出”所用稀氨水浓度为6mol/L,则配制100mL该氨水需12mol/L的浓氨水的体积为______mL,若量取该浓氨水时俯视刻度线,会导致配制的稀氨水浓度________(填“偏高”、“偏低”或“无影响”)。
(2)检验“过滤1”所得沉淀是否洗净的实验方法是_______________________________。
(3)请写出“电解”熔融氧化铝制取金属铝的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图所示。试回答:
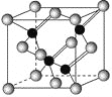
(1)镓的基态原子的电子排布式是______。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为___,与同一个镓原子相连的砷原子构成的空间构型为____。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是___ (用氢化物分子式表示)。
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为____。
(5)比较二者的第一电离能:As____Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是__(填字母)。
A.砷化镓晶胞结构与NaCl相同 B.电负性:As>Ga C.砷化镓晶体中含有配位键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com