
【题目】明矾可用于制取钾肥和冶炼铝,具体工艺流程如下图所示:
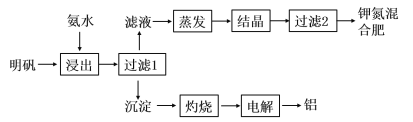
(1)“浸出”反应的离子方程式为__________________________________。“浸出”所用稀氨水浓度为6mol/L,则配制100mL该氨水需12mol/L的浓氨水的体积为______mL,若量取该浓氨水时俯视刻度线,会导致配制的稀氨水浓度________(填“偏高”、“偏低”或“无影响”)。
(2)检验“过滤1”所得沉淀是否洗净的实验方法是_______________________________。
(3)请写出“电解”熔融氧化铝制取金属铝的化学方程式________________________。
【答案】Al3++3NH3H2O = Al(OH)3 ↓+3NH4+ 50 偏低 取最后一次洗涤液于试管中,加入足量稀盐酸,再加BaCl2溶液,若无白色沉淀产生,则证明已洗净 2Al2O3 ![]() 4Al+3O2↑
4Al+3O2↑
【解析】
明矾为十二水和硫酸铝钾,用氨水浸出时,铝离子与氨水反应生成氢氧化铝和铵根离子,则沉淀为氢氧化铝,灼烧生成氧化铝,电解生成铝单质和氧气;滤液为硫酸钾、硫酸铵的混合液,蒸发结晶,过滤可得钾氮混合肥。
(1)铝离子与氨水反应生成氢氧化铝和铵根离子,离子方程式为Al3++3NH3H2O = Al(OH)3 ↓+3NH4+;溶液的稀释时,溶质的物质的量不变,则6×100=12×V,V=50mL;量取该浓氨水时俯视刻度线,导致量取浓氨水的体积减小,则物质的量减小,配制溶液的浓度偏低;
(2)若沉淀未洗净时,沉淀表面会含有硫酸根离子,可用氯化钡检验其存在,检验方法为取最后一次洗涤液于试管中,加入足量稀盐酸,再加BaCl2溶液,若无白色沉淀产生,则证明已洗净;
(3)电解熔融状态的氧化铝时,生成铝和氧气,方程式为2Al2O3 ![]() 4Al+3O2↑。
4Al+3O2↑。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置如图所示。回答下列问题:
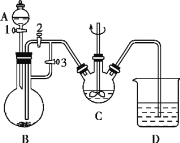
(1)C仪器的名称是___,FeCO3在其中生成,该装置中发生的主要反应的离子方程式为___。
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,其目的是___,关闭活塞1,一段时间后,再关闭活塞___打开活塞__,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
Ⅱ.乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O,Mr =288g/mol)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应,结束后,无需过滤,除去过量铁粉的反应方程式为2CH3CH(OH)COOH+Fe=(CH3CH(OH)COO)2Fe+H2↑;从上述所得溶液中获得乳酸亚铁晶体的方法是____、过滤、洗涤、干燥。
(4)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数。发现产品的质量分数总是大于100%,其原因可能是___。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1的Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2标准溶液19.70mL。滴定反应为Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4![]() K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是_____(填化学式),反应中若产生0.3mol的气体则有________mol的电子转移。
(2)a+b的最大值为________,a+b最小值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Cl2是一种有毒气体,不可用于自来水的杀菌消毒
C.SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
D.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。(已知:装置C的作用是吸收Cl2)
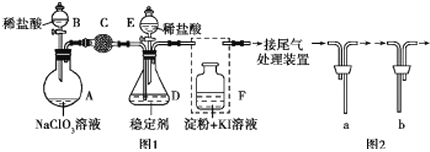
(1)仪器B的名称是________。安装F中导管时,应选用图2中的_________________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜_______________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,NaClO2中Cl的化合价为______。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________。
(5)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应离子方程式为___________________。(已知:在酸性条件下SO32-被ClO3-氧化为SO42-)
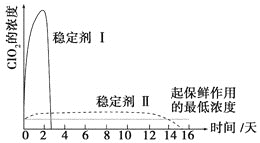
(6)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__________,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:

(1)实验一:将开关K与a连接,则乙为_____极,电极反应式为______。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镀下列金属中的一种以防止铁被腐蚀,正确的选择是____(填字母编号)。
A.Cu B.Zn C.Sn D.Ag
(3)实验二:开关K与b连接,则乙__极,总反应的离子方程式为______。
(4)对于实验二,下列说法正确的是____(填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.反应在结束后,甲电极和乙电极上收集到的气体体积一定相等
(5)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现________(填“甲”或“乙”)极附近变红。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2mol NO2 装入 5 L 带活塞的密闭容器中,当反应 2NO2(g) N2O4(g)ΔH=-60 kJ/mol 达到平衡时,恢复到原来的温度,测得此过程中体系向外界共释放了 40 kJ 的热量。 下列说法正确的是( )
A.温度升高,平衡常数 K 增大
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.上述反应达到平衡时,NO2的转化率是 40%
D.若起始时向容器中充入 1.0 mol N2O4,保持温度不变,达到平衡时共吸收 20 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。某温度下,将 2 mol SO2 和 1 mol O2 置于 10L 密闭容器中,反应达平衡后,SO2 的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g)ΔH<0。某温度下,将 2 mol SO2 和 1 mol O2 置于 10L 密闭容器中,反应达平衡后,SO2 的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
甲 乙
乙 丙
丙
A.由图甲推断,B 点 SO3的平衡浓度为 0.3molL1
B.在图甲中,在此温度下,C 点 υ 正<υ 逆
C.达到平衡后,保持体积不变,充入氦气,压强增大,则反应速率变化图像可以用图乙表示
D.压强为 0.50 MPa 时,不同温度下 SO2 的平衡转化率与时间关系如图丙,则 T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com