
【题目】下列叙述正确的是
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Cl2是一种有毒气体,不可用于自来水的杀菌消毒
C.SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
D.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由C元素形成的单质,已知甲+乙=丁+己,甲+丙=戊+己,0.1mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
A. 原子半径:D>C >B>A
B. B元素只能形成一种二元含氧酸,且B元素的含氧酸对应的酸酐一定是氧化物
C. 1mol甲与足量乙反应转移电子的数目为NA
D. 1.0L 0.1mol·L-1戊溶液中阴离子总的物质的量小于0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的 Fe、FeO、![]() 的混合物中,加入 100mL1mol/L 的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中,加入 KSCN 溶液无血红色出现。若用足量的 CO 在高温下还原 相同质量的混合物,能得到铁的质量为( )
的混合物中,加入 100mL1mol/L 的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中,加入 KSCN 溶液无血红色出现。若用足量的 CO 在高温下还原 相同质量的混合物,能得到铁的质量为( )
A.2.8gB.5.6gC.11.2gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿中主要含有Al2O3、Al(OH)3还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示:
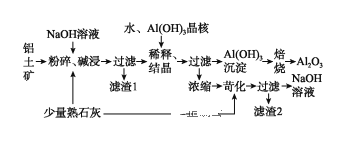
请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是____________________。滤渣1的主要成分为________________。
(2)Al2O3与NaOH溶液反应的离子方程式为____________________________________。
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的_________气体的方法来代替。(已知:通入该气体后,其产物之一可用来做发酵粉)。
(4)焙烧过程中发生的化学方程式为_________________________________。
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:_________________________________________________。
(6)该生产流程能实现____________________(填化学式)的循环利用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的化学方程式:______________________。
(2)某工程师为了从使用过的腐蚀废液(主要含CuCl2、FeCl3溶液等)中回收铜,并重新获得纯净的FeCl3溶液,准备采用如图所示流程:(已知:加过量①为Fe;加过量④为稀盐酸;通入⑥为Cl2)
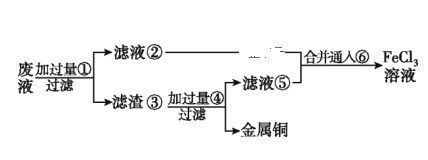
①上述实验中滤渣③的主要物质为___________________(填化学式),写出向②⑤的合并液中通入⑥的离子方程式:______________________________。
②配制并保存FeCl2溶液时,需加入铁屑,其目的是_______________________________。
③要证明FeCl3溶液是否含有Fe2+,可选择下列选项中的______________(已知:加入该物质后,生成蓝色沉淀)。
A.加入 K3[Fe(CN)6]溶液 B.加入NaOH溶液 C.加入KSCN溶液
(3)现有1.2 L含3 mol FeCl2的酸性溶液恰好与0.6 mol HIO3完全反应,还原产物为_______(填化学式,已知该物质遇淀粉溶液变蓝),该反应离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾可用于制取钾肥和冶炼铝,具体工艺流程如下图所示:
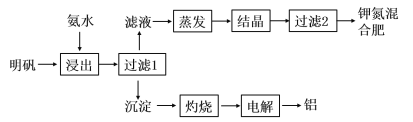
(1)“浸出”反应的离子方程式为__________________________________。“浸出”所用稀氨水浓度为6mol/L,则配制100mL该氨水需12mol/L的浓氨水的体积为______mL,若量取该浓氨水时俯视刻度线,会导致配制的稀氨水浓度________(填“偏高”、“偏低”或“无影响”)。
(2)检验“过滤1”所得沉淀是否洗净的实验方法是_______________________________。
(3)请写出“电解”熔融氧化铝制取金属铝的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)基态碳原子核外有________种能量不同的电子, 其核外电子运动状态由_____ 种因素决定。
(2)CH4分子间不能形成氢键, 主要原因是CH4 分子中的碳原子不含孤对电子、_____ 、 _____________。
(3)碳酸的非羟基氧的个数和磷酸的非羟基氧的个数都是1, 从结构上分析,它们的强度 相近,均为中强酸。然而事实上二氧化碳水溶液的酸性却很弱,原因是__________。
(4)乙二胺(H2NCH2CH2NH2)是 一种有机化合物, N 原子的杂化轨道类型为______,乙二胺通过配位键能与Cu2+ 形成稳定的环状配离子,其结构可表示为__________。
(5)金刚石是碳的一种同素异形体,属于_______ 晶体。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A 所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图 ___________(从 A~D 图中选填).
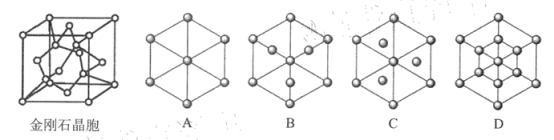
若碳原子半径为r ,金刚石晶胞中碳原子的空间占有率为_____________( 用含π 的代数.式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关。
(1)乙烯是石油化工重要的基础原料。 写出乙烯的电子式____________
(2)分子式为C5H12的某烃,分子中含有4个甲基,该烃的结构简式为_______________________。
(3)与乙烯互为同系物的是_______ 。(选填编号)
a. CH3CH=CH2 b. CH2=CHCH=CH2
c. CH≡CH d. CH3CH3
(4)聚乙烯安全无毒,可用于制食品包装袋。聚乙烯的结构简式为 ________________ 。
(5)乙炔三聚可得到苯或二乙烯基乙炔 (CH2=CH-C-C-CH=CH2) 。鉴别苯和二乙烯基乙炔可用的试剂是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com