
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是:____________,产物中单质B是________。
(2)②中所发生的各反应的化学方程式为____________________、________________。
(3)③中所发生的各反应的离子方程式为___________________、_____________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
【答案】在A和铝粉的混合物表面加少量KClO3,插上镁带并将其点燃 Fe Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ 0.67 mol·L-1 2.3 mol·L-1
【解析】
①MgO不能与铝发生置换反应,所以发生的反应是Fe2O3+2Al![]() 2Fe+Al2O3;②中发生的反应是Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O;④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,则③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑,溶液D为MgCl2、FeCl2的混合溶液。
2Fe+Al2O3;②中发生的反应是Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O;④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,则③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑,溶液D为MgCl2、FeCl2的混合溶液。
(1)①中引发铝热反应的实验操作是:在A和铝粉的混合物表面加少量KClO3,插上镁带并将其点燃,产物中单质B是Fe;
答案:在A和铝粉的混合物表面加少量KClO3,插上镁带并将其点燃 Fe
(2)根据上面分析可知②中所发生的各反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O;
答案:Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O
(3) 上面分析可知③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑,反应的离子方程式为Fe+2H+=Fe2++H2↑ ,Fe+2Fe3+=3Fe2+;
答案:Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+
(4)根据题意,假设20 g A中MgO和Fe2O3的物质的量均为x mol,则x mol×40 g·mol-1+x mol×160 g·mol-1=20 g,解得x=0.1。溶液D中Mg2+的物质的量等于MgO的物质的量,即n(Mg2+)=0.1mol,故c(Mg2+)=0.1mol÷0.15L≈0.67mol·L-1;步骤③中反应发生后原先加入的盐酸中的Cl-全部转移到FeCl2和MgCl2中,根据Cl-守恒和电荷守恒可知,溶液D中:n(Cl-)=n(Mg2+)×2+n(Fe2+)×2=6.0 mol·L-1×0.15 L=0.9 mol,n(Fe2+)=0.35 mol,故c(Fe2+)=0.35mol÷0.15L≈2.3 mol·L-1。
答案:0.67 mol·L-1 2.3 mol·L-1


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】实验室用O2氧化NH3制备硝酸的装置如图所示(夹持装置略),下列说法不正确的是

A.球形干燥管B中可以填充碱石灰或五氧化二磷
B.实验过程中,若熄灭酒精灯,装置C中的氧化铬继续保持红热,说明装置C中的反应放热
C.球形干燥管D中的无水氯化钙可吸收尾气中的氨气和水蒸气
D.装置E中的石蕊试液最终变红,说明锥形瓶中有硝酸产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 mL 2 mol·L-1Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
向圆底烧瓶中先加入10gKClO3固体和9gH2C2O4·2H2O(草酸),然后再加入5mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~80℃,至B中广口瓶内溶液呈深红黄色时停止加热。
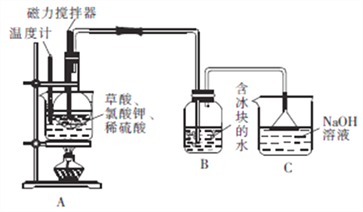
回答下列问题:
(1)装置A用水浴加热的优点是_________________;装置A中水浴温度不宜低于60℃也不宜高于80℃,其原因是______________________。
(2)装置A中反应生成ClO2及KHSO4等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C的作用是_______________
Ⅱ.设计实验验证ClO2的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种非常重要的化工原料,利用苯可以合成多种有机物。有人设计了合成芳纶、PF树脂和肉桂酸乙酯的路线,如下图:
 回答下列问题:
回答下列问题:
(1)反应条件1是____________。
(2)B分子中的官能团的名称为_________,B→C的反应类型为____________。
(3)D的结构简式为________,生成PF树脂的化学方程式为_______________。
(4)试剂E是_________。
(5)由J合成肉桂酸乙酯的化学方程式为 _____________________。
(6)写出同时满足下列条件的肉桂酸乙酯的一种同分异构体__________。
①苯环上仅有2个取代基且处于对位
②能发生水解反应和银镜反应,其中一种水解产物遇FeCl3溶液显色
③存在顺反异构
(7)以D为原料,选用必要的无机试剂合成乙二醛,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上或下注明试剂和反应条件)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4![]() K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是_____(填化学式),反应中若产生0.3mol的气体则有________mol的电子转移。
(2)a+b的最大值为________,a+b最小值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。(已知:装置C的作用是吸收Cl2)
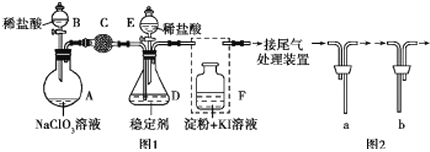
(1)仪器B的名称是________。安装F中导管时,应选用图2中的_________________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜_______________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,NaClO2中Cl的化合价为______。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________。
(5)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应离子方程式为___________________。(已知:在酸性条件下SO32-被ClO3-氧化为SO42-)
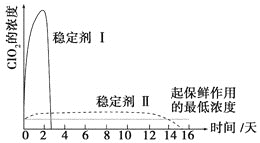
(6)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__________,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol/L NaOH溶液滴定0.10mol/L HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示,下列叙述错误的是

A. 当滴定至溶液呈中性时,c(A-)>c(HA)B. N点,c(Na+)·c(A-)=![]()
C. Ka(HA)的数量级为10-5D. P-Q过程中,水的电离程度逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com