
科目: 来源: 题型:
【题目】T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(I)所示。保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示。下列结论正确的是( )
图(I)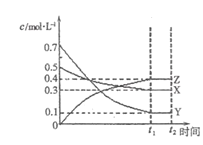 图(Ⅱ)
图(Ⅱ)
A.图(Ⅱ)中T1>T2,则正反应是吸热反应
B.t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大
D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z,保持其他条件不变,达到平衡时Z的浓度为0.4 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下装置进行铁与水反应的实验,虚线框处的装置用来检验生成的气体。下列说法正确的是(已知:Fe + 2Fe3+ = 3Fe2+)
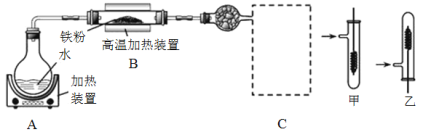
A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲
C.实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑变红
D.实验后,将装置B中的固体溶于足量稀硫酸,所得溶液中一定含有Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:

(1)实验一:将开关K与a连接,则乙为_____极,电极反应式为______。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镀下列金属中的一种以防止铁被腐蚀,正确的选择是____(填字母编号)。
A.Cu B.Zn C.Sn D.Ag
(3)实验二:开关K与b连接,则乙__极,总反应的离子方程式为______。
(4)对于实验二,下列说法正确的是____(填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.反应在结束后,甲电极和乙电极上收集到的气体体积一定相等
(5)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现________(填“甲”或“乙”)极附近变红。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质不能实现直接转化的是( )
A.C→CO2→NaHCO3→Na2CO3
B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3
D.Na→Na2O2→Na2CO3→NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③B.④>③>②>①
C.①>②>④>③D.①>②>③>④
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示(A中加热装置省略)。
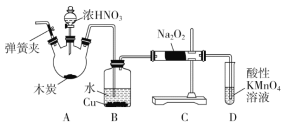
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)A装置中反应的化学方程式为_________。
(2)B装置中主要的现象是________。
(3)检验C装置产物中有亚硝酸钠的方法是_______。
(4)D装置中反应的离子方程式为________。
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和________。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为________。
(6)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________(填序号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯 c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯e.关闭分液漏斗欧旋塞 f.停止通入N2
查看答案和解析>>
科目: 来源: 题型:
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3、FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
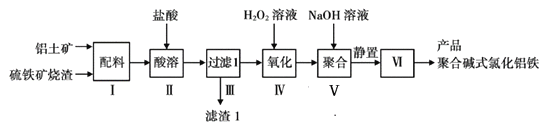
(提示:SiO2为难溶于盐酸的固体)
(1)配料中属于两性氧化物的是_________________,步骤Ⅱ酸溶时,Al2O3被溶解的离子方程式为___________________________________。
(2)“滤渣1”的主要成分为________(填化学式)。
(3)步骤Ⅳ加入H2O2溶液的目的是__________,发生反应的离子方程式为____________。
(4)步骤Ⅴ加入适量NaOH溶液发生反应生成聚合碱式氯化铝铁,若NaOH过量,可能造成的影响是_________;步骤Ⅵ包含的操作有________、洗涤、干燥。
(5)测定聚合碱式氯化铝铁[FeaAlb(OH)xCly]n中n(Fe)/n(Al)的比值的步骤如下:
步骤1:准确称取产品5.7100g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.3500g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.8000g。
计算产品中![]() 的比值为____________。
的比值为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾可用于制取钾肥和冶炼铝,具体工艺流程如下图所示:
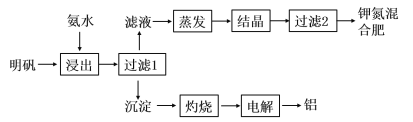
(1)“浸出”反应的离子方程式为__________________________________。“浸出”所用稀氨水浓度为6mol/L,则配制100mL该氨水需12mol/L的浓氨水的体积为______mL,若量取该浓氨水时俯视刻度线,会导致配制的稀氨水浓度________(填“偏高”、“偏低”或“无影响”)。
(2)检验“过滤1”所得沉淀是否洗净的实验方法是_______________________________。
(3)请写出“电解”熔融氧化铝制取金属铝的化学方程式________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。部分化学键的键能如下表:
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/kJmol-1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO) (丙容器/span>)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
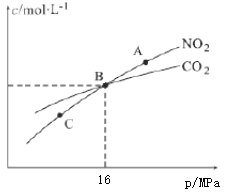
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com