
科目: 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( )
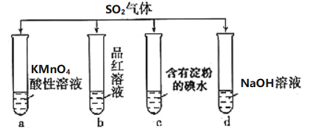
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中蓝色退去,说明还原性:SO2>I-
D.试管d中无明显现象,说明SO2不是酸性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
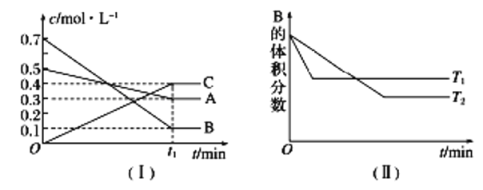
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________,正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______(填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10mol/L NaOH溶液滴定0.10mol/L HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示,下列叙述错误的是

A. 当滴定至溶液呈中性时,c(A-)>c(HA)B. N点,c(Na+)·c(A-)=![]()
C. Ka(HA)的数量级为10-5D. P-Q过程中,水的电离程度逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
(1)当反应达到平衡时,N2和H2的转化率比是_____。升高平衡体系的温度(保持容积不变),混合气体的平均相对分子质量______,密度____。(填“变大”、“变小”或“不变”)
(2)当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度___(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是( )
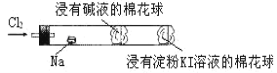
A.钠着火燃烧产生苍白色火焰,并生成大量白烟
B.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收
D.实验过程中氯元素原子并不都是被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油![]() 即在汽油中添加一定量的甲醇
即在汽油中添加一定量的甲醇![]() ,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体
,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体![]() 一氧化碳
一氧化碳![]() 排放将近100万吨。甲醇常利用煤气化过程中生成的CO和
排放将近100万吨。甲醇常利用煤气化过程中生成的CO和![]() 来制备:CO+2H2
来制备:CO+2H2![]() CH3OH,
CH3OH,

请根据图示回答下列问题:
(1)关于该反应的下列说法中,正确的是______![]() 填字母
填字母![]() :
:
A.![]() ,
,![]()
![]() ,
,![]() C.
C.![]() ,
,![]()
![]() ,
,![]()
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和![]() ,净测得CO和
,净测得CO和![]() 的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数
的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数![]() ______。
______。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.υ生成(CH3OH)=υ消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
e. 混合气体的压强不再改变
(4)恒容条件下,达到平衡后,下列措施中能使![]() 增大的有______。
增大的有______。
A.升高温度 B.充入He气 C.再充入1molCO和![]() D.使用催化剂
D.使用催化剂
(5)若在一恒容的密闭容器中充入1molCO和![]() ,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量
,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量![]() ______
______![]() 。(结果保留3位有效数字)
。(结果保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为NaOH溶液,则丁可能是CO2B.若乙为Al(OH)3,则丁可能是NaOH
C.若甲为Fe,则丁可能是Cl2D.若丁是O2,则甲可能为C
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,工作原理如图所示,其中各电极未标出。下列有关说法错误的是( )
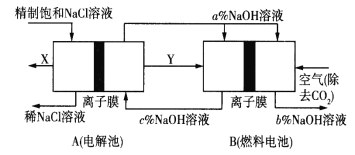
A.A池中右边加入NaOH溶液的目的是增大溶液的导电性
B.两池工作时收集到标准状况下气体X为2.24L,则理论上此时充入标准状况下的空气(不考虑去除CO2的体积变化)的体积约为5.6L
C.A为阳离子交换膜、B为阴离子交换膜
D.氢氧化钠的质量分数从大到小的顺序为b%>a%>c%
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。某温度下,将 2 mol SO2 和 1 mol O2 置于 10L 密闭容器中,反应达平衡后,SO2 的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g)ΔH<0。某温度下,将 2 mol SO2 和 1 mol O2 置于 10L 密闭容器中,反应达平衡后,SO2 的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
甲 乙
乙 丙
丙
A.由图甲推断,B 点 SO3的平衡浓度为 0.3molL1
B.在图甲中,在此温度下,C 点 υ 正<υ 逆
C.达到平衡后,保持体积不变,充入氦气,压强增大,则反应速率变化图像可以用图乙表示
D.压强为 0.50 MPa 时,不同温度下 SO2 的平衡转化率与时间关系如图丙,则 T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com