
科目: 来源: 题型:
【题目】硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为 PbS, 含有FeS2等杂质)和软锰矿(主要成分为MnO2 ) 制备PbSO4的工艺流程如图:
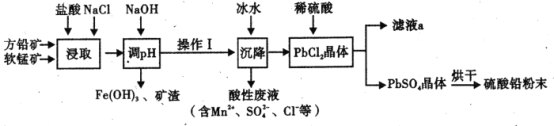
已知:
i. PbCl2难溶于冷水,易溶于热水
ii. PbCl2 (s) + 2 Cl- ( aq ) ![]() PbCl42-( aq ) △H> 0
PbCl42-( aq ) △H> 0
iii.Ksp(PbSO4) =1. 08 ×10-8 , Ksp(PbC12) = 1. 6× 10 -5
(1)“浸取”过程中盐酸与MnO2 、P bS 发生反应生成PbCl2和S 的化学方程式为______________,加入NaCl 的目的是__________________。
(2)沉降操作时加入冰水的作用是_______________________。
(3) 20°C 时 ,PbCl2 ( s) 在不同浓度盐酸中的最大溶解量( g L-1 ) 如图所示。下列叙述正确的是_____________(填字母)

A. 盐酸浓度越小,Ksp(PbC12)越小
B.x、y 两点对应的溶液中c( Pb2+ )不相等
C 当盐酸浓度为1 mol L-1 时,溶液中c( Pb2+)一定最小
D. 当盐酸浓度小于1 mol L-1时 ,随 HCl 浓度增大,P bCl2 溶解量减少是因为 Cl-浓度增大使 PbCl2溶解平衡逆向移动
(4)调 pH 的目的是__________,PbC12 “转化”后得到 PbSO4, 当c (Cl-)= 0.100mol/L 时 ,c( SO42-) =________________。
(5)滤液 a 经过处理后可以返回到______工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂--三盐基硫酸 (3 PbOPbSO4H2O) ,写出该反应的化学方程式 _____________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
科目: 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
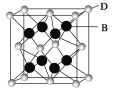
【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______,CA3分子的空间构型是_____。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________(填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓由大到小的顺序是____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3,并请写出计算过程。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为![]() 、体积分别为
、体积分别为![]() 和
和![]() 的
的![]() 溶液与
溶液与![]() 溶液按不同体积比混合,保持
溶液按不同体积比混合,保持![]() ,
,![]() 、
、![]() 与混合液的
与混合液的![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
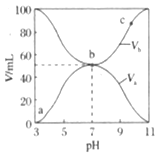
A. ![]()
B. b点,![]()
C. a、b、c三点,c点时水电离出的![]() 最大
最大
D. ![]() 点过程中,可能存在
点过程中,可能存在![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,32 g氧气所含的原子数为NA
B.标准状况下,22.4 L 四氯化碳的分子数为NA
C.0℃,101 kPa下,44.8 L氮气所含有的分子数为2NA
D.常温常压下,1 mol氦气含有的分子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是

有关数据如下表所示:
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
A.该电池的正极反应式为MnO2+eˉ+H+=MnOOH
B.利用干电池,高温电解H2O–CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C.废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D.废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com