
科目: 来源: 题型:
【题目】(1)欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3的物质的量为____mol(已知:KClO3被还原成KCl)。
(2)向200mL0.1mo/L 的Fe(NO3)2溶液中加入适量的NaOH 溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧后得到固体的质量为___g。
(3)将0.51g的Mg、Al混合物溶于500mL,4mol/L HCl,加入2mol/L NaOH,要使沉淀的量达到最大值,则加入NaOH的量最少为___mL。
(4)200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增大了7.2g,则原混合气体的物质的量为____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前含有元素硒![]() 的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是
的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是
A.原子序数为24B.最高价氧化物为SeO3,为酸性氧化物
C.原子半径比钙小D.气态氢化物分子式为H2Se,受热较容易分解
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图,下列说法不正确的是
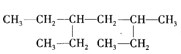
A.该有机物属于饱和链烃
B.该烃的名称是2,4-二乙基己烷
C.该烃与2,5-二甲基-3-乙基己烷互为同分异构体
D.该烃的一氯代物共有8种
查看答案和解析>>
科目: 来源: 题型:
【题目】苯酚是一种很有价值的化工原料,年产量可达几百万吨。苯酚可合成著名的解热镇痛药——阿司匹林,也可合成聚碳酸酯,其合成路线如下:

(1)阿司匹林分子中的含氧官能团名称为_______;G的化学名称是____。
(2)E为饱和一元酮,其结构简式为________;H和K合成聚碳酸酯的反应类型是_____。
(3)鉴别G和阿司匹林的一种显色试剂为___________
(4)已知K的相对分子质量为99,其分子式为____________
(5)写出阿司匹林与足量NaOH溶液反应的化学方程式_________
(6)写出能同时满足以下条件的阿司匹林的两种异构体的结构简式_______________
①苯环上只有两种一氯代物;②含有羧基;③水解产生酚。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物G(1,4-环己二醇)是重要的医药中间体和新材料单体,可通过以下流程制备。
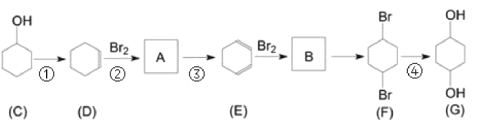
完成下列填空:
(1)写出C中含氧官能团名称_____________。
(2)判断反应类型:反应①________;反应②_______。
(3)写出B的结构简式_______________。
(4)写出反应③的化学方程式_________。
(5)一定条件下D脱氢反应得一种产物,化学性质稳定,易取代、难加成。该产物属于____(填有机物类别),说明该物质中碳碳键的特点________________________。
(6)写出G与对苯二甲酸在一定条件下反应生成高分子物质的化学方程式_____________。
(7)1,3-丁二烯是应用广泛的有机化工原料,它是合成D的原料之一,它还可以用来合成氯丁橡胶(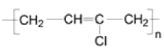 ).写出以1,3-丁二烯为原料制备氯丁橡胶的合成路线。(合成路线常用的表示方式为:A
).写出以1,3-丁二烯为原料制备氯丁橡胶的合成路线。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_______________
目标产物)_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。已知K2FeO4在低于常温的碱性环境中稳定,酸性条件下,其氧化性强于KMnO4、Cl2等。某小组设计制备K2FeO4并测定其纯度的实验步骤如下:
I.制备次氯酸钾。在搅拌和冰水浴条件下,将Cl2通入浓KOH溶液,同时补加一定量KOH,产生了大量白色沉淀,抽滤后得到浓KClO滤液。
II.制备高铁酸钾(装置如图)
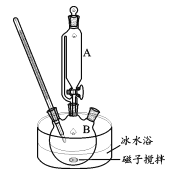
碱性条件下,向如图装置加入上述浓KClO 溶液与冰水浴磁子搅拌Fe(NO3)3;饱和溶液,反应一段时间,得到紫黑色溶液和大量白色沉淀,抽滤分离,用冰盐浴进一步冷却滤液得到K2FeO4粗品。
III.测定高铁酸钾样品的纯度。取0.300g上述步骤制备的K2FeO4样品于锥形瓶,在强碱性溶液中,用过量CrO2-与FeO42-反应生成 CrO42-和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol/L(NH)2Fe(SO4)2标准溶液滴定 Cr(VI)至 Cr3+,终点消耗 20.0mL。
(1)步骤I制备次氯酸钾的化学方程式为_____;“补加一定量KOH”的目的除了与过量Cl2继续反应生成更多KClO外,还在步骤II中起到___________的作用。
(2)根据 K2FeO4理论合成产率与合成条件响应曲面投影图(见图,虚线上的数据表示K2FeO4的理论合成产率),步骤II中控制的条件应是:温度______ (序号,下同),反应时间_____________。
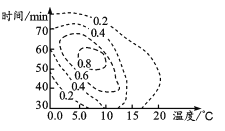
a.0.0~5.0℃ b.5.0~10℃ c.10~15℃ d.40~50 min e.50~60 min f.60~70 min
(3)步骤II中,为了避免副产物K3FeO4的产生,Fe(NO3)3饱和溶液应放在仪器A中,A的名称是________;写出实验刚开始时生成FeO42-的离子方程式________。
(4)根据步骤皿I的测定数据,计算高铁酸钾样品纯度为_____(保留3位有效数字)。
(5)为探究酸性条件下FeO42-氧化性强弱,甲同学取步骤II所得K2FeO4粗品加入到少量盐酸中,观察到产生黄绿色气体,经检验气体为Cl2。该现象能否证明“酸性条件下FeO42-氧化性强于Cl2”,并说明理由_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3![]() TiCl4↑+TiCl2回答下列问题。
TiCl4↑+TiCl2回答下列问题。
(1)某同学所画基态 Cl-的外围电子排布图为![]() ,这违反了____________
,这违反了____________
(2)从结构角度解释 TiCl3中Ti(III)还原性较强的原因____________。
(3)钛的氯化物的部分物理性质如下表:
氯化物 | 熔点/℃ | 沸点/℃ | 溶解性 |
TiCl4 | -24 | 136 | 可溶于非极性的甲苯和氯代烃 |
TiCl2 | 1035 | 1500 | 不溶于氯仿、乙醚 |
①TiCl4与TiCl2的晶体类型分别是____________。
②TiCl4与SO42-互为等电子体,因为它们____________相同;SO42-中心原子以3s轨道和3p轨道杂化。
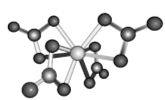
(4)Ti的配合物有多种。Ti(CO)6、Ti(H2O)63+、TiF62-的配体所含原子中电负性最小的是__________;Ti(NO3)4的球棍结构如图,Ti的配位数是_____________
(5)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图:
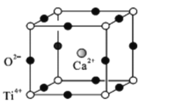
①设N为阿伏加德罗常数的值,计算一个晶胞的质量为______________g.
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则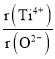 =_________。
=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生命活动密切相关。以下是人体中血红蛋白、肌红蛋白与O2结合机制的相关研究,假定其环境温度均为36.8℃。
(1)血红蛋白Hb结合O2形成动脉血,存在反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O
HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O![]() H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
(2)肌肉中大量肌红蛋白 Mb也可结合O2形成MbO2,即反应③:Mb(aq)+O2(g)![]() MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=![]() 。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,
。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中, =4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
=4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
(3)Hb分子具有四个亚基,且每个亚基有两种构型(T型和R型)。图中,T0、R0表示未结合O2的T型和R型,且存在可逆的变构效应:T0![]() R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4
R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4![]() R4也是变构效应,正向平衡常数为K4。
R4也是变构效应,正向平衡常数为K4。

①已知某肺炎病人肺脏中T0+4O2![]() T4反应的n(O2)数据如下:
T4反应的n(O2)数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(O2)/10-6 mol | 1.68 | 1.64 | 1.58 | 1.50 | 1.40 |
计算2.0 min~8.0 min内以T的物质的量变化表示的反应速率v(T4)为_________mol·min-1。
②现假定R型Hb对O2的结合常数为KR,T型Hb对O2的结合常数为KT。已知KR>KT,则图中K0____K4(填“>”或“<”)。
(4)氧气是生命活动必不可少的物质。如下图所示,以Pt为阳极,Pb(CO2)的载体,使CO2活化为阴极,电解经CO2饱和处理的KHCO3溶液可使氧气再生,同时得到甲醇。其阴极反应式为____;从电解后溶液中分离甲醇的操作方法是_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】以乙炔与甲苯为主要原料,按下列路线合成一种香料W:
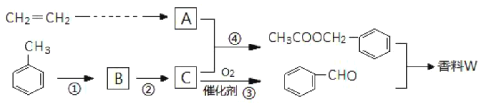
(1)写出实验室制备乙炔的化学方程式___________。
(2)反应①的反应试剂、条件是________,上述①~④反应中,属于取代反应的是________。
(3)写出反应③的化学方程式_____________。
(4)检验反应③是否发生的方法是_______。
(5)写出两种满足下列条件的![]() 同分异构体的结构简式______。
同分异构体的结构简式______。
a.能发生银镜反应 b.苯环上的一溴代物有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com