
科目: 来源: 题型:
【题目】某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行请根据上面流程,回答以下问题:
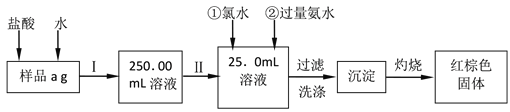
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、_________。(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是__________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入过量氨水时发生的离子反应方程式____________,
(4)检验沉淀是否已经洗涤干净的操作是__________。
(5)若原样品质量a为10g,加热后红棕色固体质量是6g,则样品中铁元素的质量分数是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说法正确的是( )

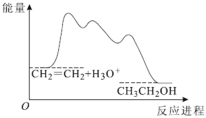
A.①、②、③三步反应均释放能量
B.该反应进程中有两个过渡态
C.第③步反应原子利用率为100%
D.总反应速率由第①步反应决定
查看答案和解析>>
科目: 来源: 题型:
【题目】葡萄糖可发生如下转化:2CH3CH(OH)COOH(乳酸)![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖)![]() 2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,6.0g葡萄糖和乳酸混合物中氧原子数0.2NA
B.1mol葡萄糖中含有6.0NA个羟基
C.1mol乳酸与足量乙醇反应可生成NA个乳酸乙酯分子
D.相同条件下,相同物质的量的乳酸分别与足量的Na和NaHCO3溶液反应,产生气体的分子数均为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】钴钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有MoS2、CoS和Al2O3)中回收钴和钼的工艺流程如图:

已知:浸取液中的金属离子主要为MoO![]() 、Co2+、Al3+。
、Co2+、Al3+。
(1)钼酸铵[(NH4)2MoO4]中Mo的化合价为___,MoS2在空气中高温焙烧产生两种氧化物:SO2和___(填化学式)。
(2)酸浸时,生成MoO![]() 的离子方程式为___。
的离子方程式为___。
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取MoO![]() 和Co2+,萃取情况如图所示,当协萃比=___更有利于MoO
和Co2+,萃取情况如图所示,当协萃比=___更有利于MoO![]() 的萃取。
的萃取。

(4)向有机相1中滴加氨水,发生反应的离子方程式为___。
(5)Co2+萃取的反应原理为Co2++2HR![]() CoR2+2H+,向有机相2中加入H2SO4能进行反萃取的原因是___(结合平衡移动原理解释)。
CoR2+2H+,向有机相2中加入H2SO4能进行反萃取的原因是___(结合平衡移动原理解释)。
(6)水相2中的主要溶质除了H2SO4,还有___(填化学式)。
(7)Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,则阳极电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】将3molA和1molB混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生如下反应:3A(g)+B(g)![]() 2C(g)+D(g),达到平衡时C的浓度为wmol/L。回答下列问题:
2C(g)+D(g),达到平衡时C的浓度为wmol/L。回答下列问题:
(1)保持温度和压强不变,按下列四种配比充入容器P中有关物质,平衡后C的浓度仍为wmol/L的是___。
A.6molA+2 molB B.3molA+1molB+2molC
C.2molC+1molB+1molD D.1molC+2molD
(2)保持原起始温度和体积不变,要使平衡后C的浓度仍为wmol/L,应按下列哪种配比向容器Q中充入有关物质___。
A.3molA+1 molB
B.4molC+2molD
C.1.5molA+0.5molB+1molC+0.5molD
D.无法判断
(3)保持原起始温度和体积不变,若仍按3molA和1molB配比在容器Q中发生反应,则平衡时C的浓度和wmol/L的关系是___。
A.大于wmol/L B.小于wmol/L C.等于wmol/L D.无法比较
(4)将2molC和2molD按起始温度和压强充入容器Q中,保持温度和体积不变,平衡时C的浓度为vmol/L,则v和w的关系是___。
A.v>w B.v<w C.v=w D.无法比较
(5)将题干中的体积可变的密闭容器P改为恒容条件,在某温度下,将2.4molA和0.8molB混合于该容器中发生上述反应,达到平衡时C的物质的量为nmol。若A、B、C、D起始的物质的量分别用a、b、c、d表示,保持恒温恒容,要使反应开始时向逆反应进行,且达到平衡后C的物质的量仍为n mol,则起始时C的物质的量取值范围是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】对CO2及氮氧化物的研究有更大意义:
(1)CO2与H2可用来合成可再生能源甲醇,已知CH3OH(l)标准燃烧热△H=-726.5kJ/mol、H2的燃烧热数值为285.8kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=___。
CH3OH(l)+H2O(l) △H=___。
(2)用NH3催化还原NOx时包含以下反应。
反应I:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H1<0
5N2(g)+6H2O(l) △H1<0
反应Ⅱ:4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g) + 6H2O(l) △H2>0
5N2(g)+3O2(g) + 6H2O(l) △H2>0
反应Ⅲ:2NO(g) +O2(g)![]() 2NO2(g) △H3<0
2NO2(g) △H3<0
① 反应I在容积固定密闭容器内进行,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法正确的是___。
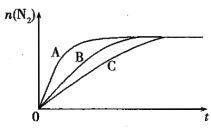
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
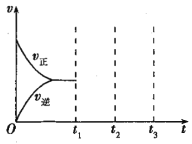
②将物质的量之比为2:1的NO、O2混合气体置于恒温密闭容器中发生反应Ⅲ,正、逆反应速率随时间变化曲线如图所示。在t1时,保持容器压强不变,充入一定量的NO2,t2时建立新的平衡,请在答题纸中画出t1~t3正、逆反应速率随时间变化曲线。___
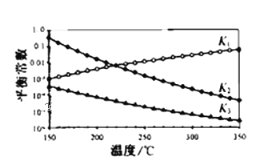
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。则△H2__△H3(填“大于”、“小于”、“等于”),理由是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组试利用镁铝合金废料(不含其它杂质)制备硫酸铝晶体,其实验流程如下:
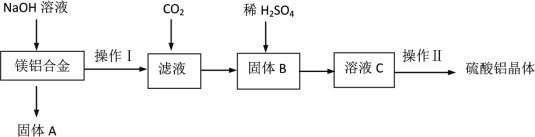
(1)在镁铝合金中加入NaOH溶液,发生反应的化学方程式为_________,固体B的化学式________。
(2)向滤液中通入足量二氧化碳的离子方程式_______________
(3)操作Ⅱ包含的实验步骤有:________、冷却结晶、过滤、洗涤、干燥。
(4)若初始时称取的镁铝合金废料的质量为7.65 g,得到固体A的质量为3.6 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%)。计算所得硫酸铝晶体的化学式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为
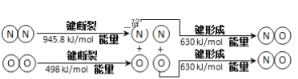
则该反应的热化学方程式为___。
(2)工业合成氨的反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
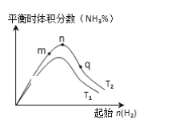
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是___点。
②T2条件下,在2L的密闭容器中,充入xmolN2和ymolH2时,3min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=___;该反应的平衡常数的值K=___。
③图像中T2___T1(填“高于”、“低于”、“等于”或“无法确定”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物P可用于治疗各种类型高血压及心绞痛,其合成路线如图所示:
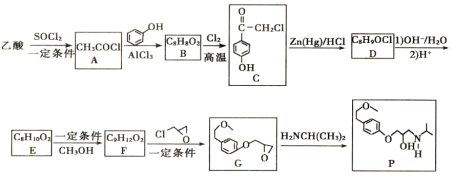
已知:![]()
![]()
(1)P中含氧官能同的名称为______________。
(2)A→B的化学方程式为_______________。
(3)C→D的反应类型为_________________。
(4)F的结构简式为____________,E→F所需的试剂和条件为______________________。
(5)芳香族化合物Q是C的同分异构体,同时满足下列条件的Q有__________种。
①苯环上有三个取代基 ②分子中含有“![]() ”原子团
”原子团
(6)J(![]() )是一种药物中间体,参照上述合成路线和相关信息,设计以苯甲酸、苯酚和
)是一种药物中间体,参照上述合成路线和相关信息,设计以苯甲酸、苯酚和![]() 为原料制备J的合成路线________________(其他无机试剂任选)。
为原料制备J的合成路线________________(其他无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com