
科目: 来源: 题型:
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)![]() 2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
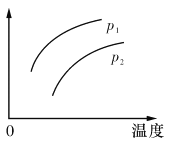
A.P1>P2,纵坐标可表示A的质量分数
B.P1<P2,纵坐标可表示C的质量贫数
C.P1>P2,纵坐标可表示混合气体的平均摩尔质量
D.P1<P2,纵坐标可表示A的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】用一种硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)制取盆景肥料NH4Fe(SO4)2及铝硅合金材料的工艺流程如下 :
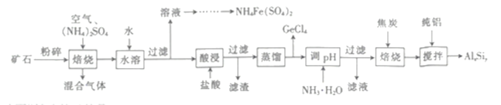
(1)“矿石”粉碎的目的是_____________________ 。
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为____________________。
②“混合气体”的主要成分是_______________ (填化学式).
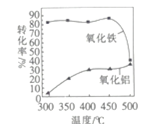
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为_______________。 Al2O3也能发生类似反应.这两种氧化物转化为硫酸盐的转化率与温度的关系如图,上述流程中最适宜的“焙烧” 温度为_____________________。
(3)GeCl4的佛点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是_________。
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为______________________。
(5)假设流程中SiO2 损失了20%,Al2O3 损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
查看答案和解析>>
科目: 来源: 题型:
【题目】探究在常温下氢氧化钡晶体与氯化铵晶体反应过程中能量变化的实验方案和实验步骤如图所示,根据下面的实验方案和步骤回答下列问题:
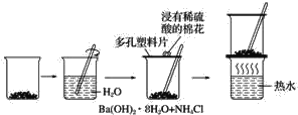
下表是某学生根据上述实验方案和步骤列表整理的实验事实和结论:
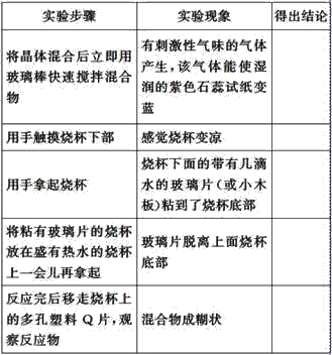
(1)请你根据实验现象得出相应的实验结论填入上表中。_________________。
(2)用化学方程式表示上述反应为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在100 ℃时,将0.100 mol的N2O4气体充入1 L 抽空的密闭容器中,发生如下反应:N2O4![]() 2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
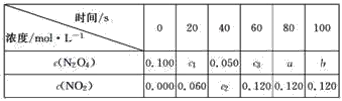
(1)达到平衡时,N2O4的转化率为______________,表中c2________c3,a________b(填“>”、“<”或“=”)。
(2)20 s时N2O4的浓度c1=________ mol·L-1,在0~20 s内N2O4的平均反应速率为________ mol·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,则要达到上述同样的平衡状态,二氧化氮的起始浓度是________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学控制适当条件,将反应Ag+Fe3+![]() Ag++Fe2+设计成如图所示的原电池装置(已知电流表指针偏向与电子的流向相同)。下列有关判断不正确的是
Ag++Fe2+设计成如图所示的原电池装置(已知电流表指针偏向与电子的流向相同)。下列有关判断不正确的是

A. 若电流表指针向右偏转,则银电极发生氧化反应
B. 若电流表指针归零时,则反应达到平衡状态
C. 电流表指针归零时,若向左烧瓶中滴加几滴AgNO3溶液,则石墨为正极
D. 上述实验能说明其他条件不变时Ag+与Fe3+的氧化性强弱与其离子浓度有关
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应:3A(g)![]() 2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
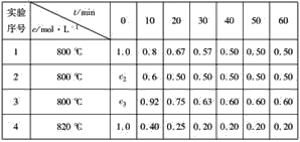
根据上述数据,完成下列填空:
(1)c2=______ mol·L-1。
(2)在实验1和2中,有一个实验使用了催化剂,根据表中数据判断,使用催化剂的实验为_______________,理由是__________________________
(3)求在实验4中,反应在0~10 min内反应物A的平均反应速率为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W、R五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其基态原子的核外成对电子数是未成对电子数的3倍;R基态原子3d轨道上的电子数是4s轨道上的4倍。请回答下列问题:(答题时,X、Y、Z、W、R用所对应的元素符号表示)
⑴基态R原子的外围电子排布式为______;Y、Z、W的电负性由大到小的顺序是____。
⑵元素Y、Z均能与元素X形成含18个电子的微粒,这些微粒中沸点最高的是______,其沸点最高的原因是______;Y2X4难溶于X2W的原因是_____。
⑶YW的结构式为______(须标出其中的配位键);在化学式为[R(ZX3)4(X2W)2]2+的配离子中与R形成配位键的原子是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
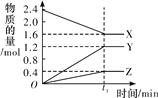
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com