
科目: 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
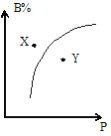
A.m+n>p
B.n>p
C.X点时混合物的正反应速率小于逆反应速率
D.X点比Y点混合物的反应速率慢
查看答案和解析>>
科目: 来源: 题型:
【题目】Zn3(PO4)2·2H2O(溶于酸,难溶于水)是一种无毒害作用的防锈颜料,利用锌浮渣(主要含Zn、ZnO、ZnCl2,还含少量的铁、锰、铜、铅及砷的化合物等)制取Zn3(PO4)2·2H2O的工艺流程如图:
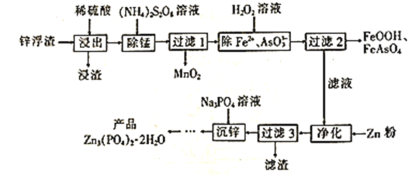
回答下列问题:
(1)“浸出”时,下列措施能提高锌的浸取率的是__(填字母)。
A.用浓硫酸代替稀硫酸 B.适当升高浸取液的温度
C.将“浸渣”再次浸取 D.缩短“浸出”时间
(2)“除锰”时,Mn2+发生反应的离子方程式为__(S2O![]() 被还原为SO
被还原为SO![]() )。
)。
(3)流程中除铁、砷时,当生成8.9gFeOOH和7.8gFeAsO4时,消耗H2O2__mol。
(4)“净化”时加锌粉的目的是__。
(5)“沉锌”时发生反应的化学方程式为__。
(6)“沉锌”至得到“产品”还需要经过的操作是__、洗涤、__。证明产品已洗涤干净的实验方法是__。
(7)Meyer等认为磷酸锌防腐机理是在钢铁表面形成组成近似为Zn2Fe(PO4)2·4H2O的覆盖膜,则在形成该覆盖膜的过程中,负极的电极反应式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学欲探究NH3的催化氧化反应,按如图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。

(1)NH3催化氧化的化学方程式是____。
(2)甲、乙两同学分别按如图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是___。
②乙观察到装置F中只有白烟生成,白烟的成分是___(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:___。
(3)为帮助乙实现在装置F中也观察到红棕色气体,如何改进___。
(4)为实现该反应,也可用如图所示的装置替换原装置中虚线框部分。
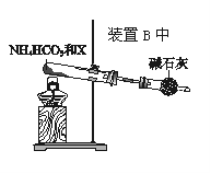
化合物X为__;NH4HCO3的作用是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】从下列实验事实所得出的相应结论不正确的是( )
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01mol·L-1的酸性KMnO4溶液分别与0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反应,后者退色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,相同温度下发生如下反应:H2(g)+I2(g) | 当其他条件不变时,纯气态反应体系的压强越大,化学反应速率越快 |
D | 将少量MnO2粉末加入盛有10%H2O2溶液的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生变化 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含有Na+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,进行如下实验:
①取100 mL上述溶液,加入足量氯化钡溶液,充分反应后将沉淀过滤、洗涤、干燥,得到4.30 g固体。向该固体中加过量的稀硝酸,仍有2.33 g固体未溶解。
②向①的滤液中加入足量NaOH,加热,产生使湿润的红色石蕊试纸变蓝的气体0.448 L(气体全部逸出,且已经换算成标准状况下体积)。以下说法正确的是
A.原溶液中SO42–、CO32–和NH4+一定存在,Cl-一定不存在
B.原溶液中一定不存在Ca2+,无法判断Na+是否存在
C.原溶液中可能存在Cl-,且c(Na+) ≥ 0.200 mol· L-1
D.为确定原溶液中Cl-是否存在,可以取实验①的滤液,加硝酸酸化的AgNO3进行检验
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组以苯乙烯和乙烯为主要原料,设计出医药中间体G的合成路线如图:

已知RCOOH![]() RCOCl
RCOCl![]() RCOOR’。
RCOOR’。
(1)B中含氧官能团的名称为___;D的结构简式为___。
(2)乙烯的某种同系物的化学名称为“甲基丙烯”,则甲基丙烯的结构简式为___。
(3)B能通过分子间脱水生成有机物X,X可用于香料,其结构中含有三个六元环状结构,则B转化为X的化学方程式:___。
(4)M是G的同分异构体,符合下列结构和性质的芳香族化合物M共有___种(不考虑立体异构)。
①1molM与银氨溶液反应最多能得4molAg;
②苯环上有四个取代基,其相对位置为![]() ;
;
③核磁共振氢谱为5组峰,且峰面积为2:2:2:2:1;
④M能发生消去反应。
写出M发生消去反应的化学方程式:___(一例即可)。
(5)设计出以甲苯为原料制备B的合成路线(无机试剂任选,已知:RCHO![]()
![]() ,RCN
,RCN![]() RCOOH)___。
RCOOH)___。
合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为__。
(2)碳可以形成多种有机化合物,如图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
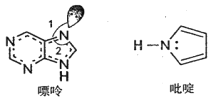
①嘌呤中所有元素的电负性由大到小的顺序__。
②吡啶结构中N原子的杂化方式是___。
③NH3的键角__PH3的键角,理由是__。
④分子中的大π键可以用符号π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯。
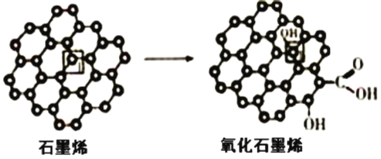
石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是__(填“变大”、“变小”“不变”)。
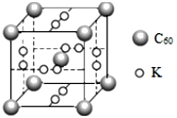
(4)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为anm该化合物中K原子和C60分子的个数比为___,该晶体的密度ρ=___g/cm3(阿伏加德罗常数为6.02×1023)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有标准状况下四种气体①8.96L![]() ; ②
; ②![]() 个
个![]() ; ③30.6g
; ③30.6g![]() ; ④
; ④![]() 。下列关系从小到大表示不正确的是( )
。下列关系从小到大表示不正确的是( )
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<①<③
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,常采用氧化还原方法处理尾气中的CO、NO。
(氧化处理法)沥青混凝土可作为反应:2CO(g)+O2(g)![]() 2CO2(g)的催化剂。
2CO2(g)的催化剂。
图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
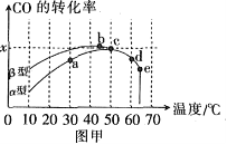
(1)在a、b、c、d四点中,未达到平衡状态的是___。
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=___(用含x的代数式表示)。
(3)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(还原处理法)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(含0.025molNO、0.5molO2和足量碳烟)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据,结果如图乙所示。
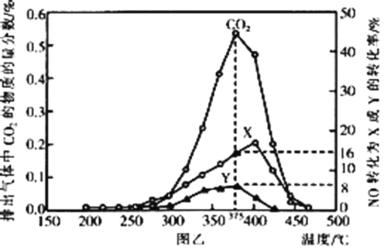
(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为___。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___。
(6)工业上常用高浓度的K2CO3溶液吸收CO2,再利用电解法使K2CO3溶液再生,其装置示意图如图:
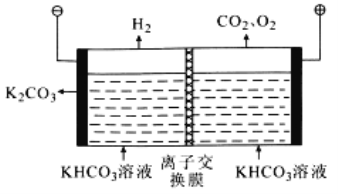
①在阳极区发生的反应包括___和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国有丰富的海水资源,海水资源开发和利用是化学研究的一项重要任务。如图是某化工厂对海水资源综合利用的示意图,有关叙述正确的是( )
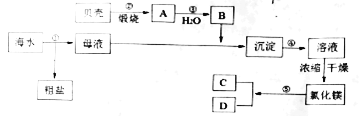
A.上述流程中步骤②~⑤涉及的化学反应包含四种基本反应类型
B.工业上冷却电解无水氯化镁所得的镁蒸气时,选择氩气或氮气
C.步骤④中加入的化学试剂可以为硝酸
D.从步骤④得到的溶液中获得的六水合氯化镁晶体,采用蒸发结晶的方式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com