
科目: 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
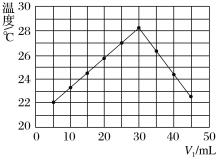
A.该实验表明化学能可以转化为热能
B.做该实验时环境温度为22℃
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下将3.36 L硫化氢通入含一定量的氢氧化钠溶液中全部吸收,氢氧化钠也全部反应,然后在低温下小心蒸发,得到不含结晶水的固体10.6 g,问所得固体中含有什么物质__________?其质量各为多少克__________?
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠是无色透明的晶体,易溶于水,其水溶液显碱性。在漂白工业中用作“脱氯剂”,常用黄铁矿(主要成分是![]() )经以下流程来制备硫代硫酸钠
)经以下流程来制备硫代硫酸钠
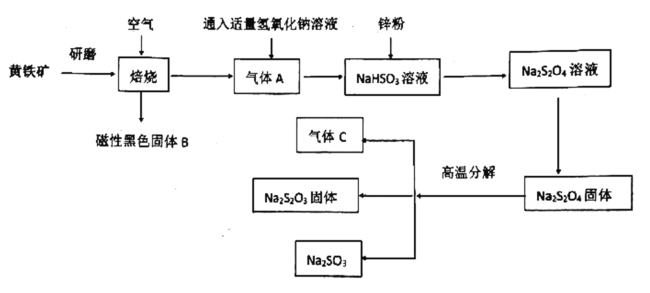
已知:气体C可以使品红溶液褪色
(1)研磨的目的是:____________,磁性黑色固体B的化学式为:________。
(2)尾气C能否用氢氧化钙溶液吸收:________(填“能”或“不能”),原因是:
________________。
(3)写出![]() 固体高温分解反应方程式:__________________________。
固体高温分解反应方程式:__________________________。
(4)![]() 溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
____________________。
(5)请用“<”符号表示出亚硫酸氢钠溶液中的各离子浓度大小关系:____________。
(6)硫代硫酸钠在漂白工业中用作“脱氯剂”,标准状况下当消耗31.6g硫代硫酸钠时吸收氯气的积为:________L。
(7)已知![]() 溶液中
溶液中![]() ,求
,求![]() 的比值________(已知:
的比值________(已知:![]() 溶液的一级电离常数为
溶液的一级电离常数为![]() ,二级电离常数为
,二级电离常数为![]() ,水的电离常数为
,水的电离常数为![]() ,请用含有
,请用含有![]() 、
、![]() 、
、![]() 、b的式子表示)。
、b的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】P4S3是黄色或淡黄色结晶或粉末,无臭、无味、易燃、有毒,遇潮气发生分解,分子结构如图所示,已知其燃烧热ΔH=3 677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是
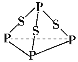
A.分子中磷元素显+3价
B.分子中每个原子最外层均达到8电子稳定结构
C.热化学方程式为P4S3(s)+8O2(g) ===P4O10(s)+3SO2(g) ΔH=3 677 kJ/mol
D.分子中存在极性键与非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
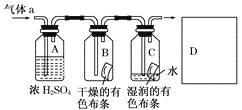
回答下列问题:
(1)该项研究(实验)的主要目的是__________________________________________.
(2)浓硫酸的作用是____________________________________________,与研究目的的直接相关的实验现象是________________________________________.
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故表现是___________,请在图中D框中以图的形式表明克服事故隐患的措施___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。
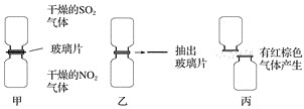
①图甲两集气瓶中________(填“上”或“下”)瓶颜色深。
②图乙中反应的现象是___________________________________________________。
③图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有____________,说明NO2在该反应中显____________性。
④由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:________________________。
(2)某课外活动小组探究镁与NO2的反应。已知镁与CO2反应如下:2Mg+CO2![]() 2MgO+C
2MgO+C
①该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式:______________________________________________________。
②设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
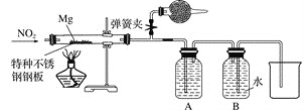
资料信息:2NO2+2NaOH===NaNO3+NaNO2+H2O
Ⅰ.装置A中的试剂是____________。
Ⅱ.干燥管和装置B的作用分别是________________________________________________、____________________。
Ⅲ.实验开始时正确的操作步骤是__________。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响,其中V1=____、T1=____;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=____。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
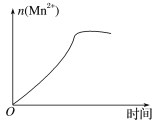
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是____,相应的粒子最可能是___(填粒子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】分析下面的能量变化示意图,下列热化学方程式正确的是

A. 2A(g)+ B(g)=2C(g)△H=a(a>0)B. 2A(g)+ B(g)=2C(g)△H=a(a<0)
C. 2A + B=2 C△H=a(a<0)D. 2C=2A +B△H=a(a>0)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com