
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA
B.常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA
C.2.0gD2O中含有的质子数、电子数均为NA
D.含1molCl+的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH![]() 数为NA
数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是:![]() ;
;![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于燃烧热的描述中正确的是( )
A. 已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1
B. 将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
A. 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH=![]() 57.3kJ/mol
57.3kJ/mol
B. 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C. 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境
D. 升高温度或加入催化剂,可以改变化学反应的反应热
查看答案和解析>>
科目: 来源: 题型:
【题目】已知粗盐水中含![]() ,含
,含![]() 。向粗盐水中加入
。向粗盐水中加入![]() 除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入
除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入![]() 除
除![]() 。
。
(1)处理上述粗盐水![]() ,至少需要加
,至少需要加![]() ________
________![]() 。(保留三位有效数字)
。(保留三位有效数字)
(2)如果用碳酸化尾气(含![]() 体积分数为0.100、
体积分数为0.100、![]() 体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2
体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2![]() 。处理上述
。处理上述![]() 粗盐水至少需要通入标准状况下________
粗盐水至少需要通入标准状况下________![]() 碳酸化尾气。(需列式计算,保留三位有效数字)
碳酸化尾气。(需列式计算,保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
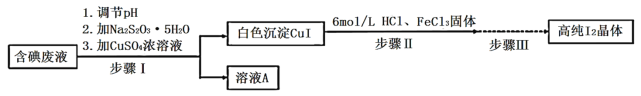
【题目】碘可利用的资源有限,因此碘的工业回收有重要意义。如图是某研究小组设计的从实验室含碘废液(主要含有![]() 、
、![]() 和淀粉等)中回收获得高纯碘晶体的流程。
和淀粉等)中回收获得高纯碘晶体的流程。
已知:![]() ,
,![]() ,实验条件下
,实验条件下![]() 不与
不与![]() 发生氧化还原反应。回答下列问题:
发生氧化还原反应。回答下列问题:
(1)步骤I中,在装有含碘废液的烧杯中,先加入![]() 固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
(2)下列有关步骤I的说法正确的是_________________。
A.实验中应调节![]() 为强酸性环境
为强酸性环境
B.![]() 溶液不能先于
溶液不能先于![]() 晶体加入,是为了防止生成的碘挥发而损失
晶体加入,是为了防止生成的碘挥发而损失
C.加入硫代硫酸钠的量应控制至含碘废液的蓝色刚好褪去
D.溶液![]() 中含硫元素的离子可能有
中含硫元素的离子可能有![]() 、
、![]() 、
、![]() 等
等
(3)步骤Ⅱ为反应生成碘并蒸馏出碘的过程,示意图如图所示:
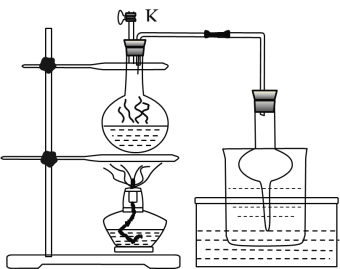
①写出步骤Ⅱ的离子方程式________。
②步骤Ⅱ,检查装置气密性(此时![]() 关闭),在圆底烧瓶中加入
关闭),在圆底烧瓶中加入![]() 和
和![]() 固体及适量
固体及适量![]() ,其后续的操作顺序是________。(选择合理操作,并排序)
,其后续的操作顺序是________。(选择合理操作,并排序)
a.打开![]() b.关闭
b.关闭![]() c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
③实验后期,发现玻璃管中少量碘晶体凝结,其处理的简易操作方法________;
(4)步骤Ⅲ中,主要涉及的操作依次是抽滤、洗涤、干燥和________。其中,抽滤、洗涤沉淀后的滤纸不能丢弃,应保留到后续操作中,其原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在中和热测定的实验中,以下操作正确的是:( )
①只在大烧杯底部垫泡沫塑料,使放入的小烧杯杯口与大烧杯杯口相平,再盖上硬纸板
②温度计测量过盐酸的温度后,立即插入![]() 溶液中测量
溶液中测量![]() 溶液的温度
溶液的温度
③将量筒中的![]() 溶液慢慢加入到小烧杯的盐酸中,边加边搅拌
溶液慢慢加入到小烧杯的盐酸中,边加边搅拌
④读取混合溶液的最高温度和最低温度,以其平均值记为最终温度.
A.只有①正确B.只有②正确
C.只有①④正确D.都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com