
科目: 来源: 题型:
【题目】如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
![]()
A. X、Y、W三种元素最低价氢化物的沸点依次升高
B. Z、X、W三种元素氧化物对应水化物的酸性依次增强
C. 由X、W和氢三种元素形成的化合物中只含共价键
D. X、Z形成的二元化合物是一种新型无机非金属材料
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)铅蓄电池是典型的二次电池,电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
(二)某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若用HNO3(浓)作电解质溶液,电极为铜片和铝片,正极上发生的电极反应式为________________;
(2)若电解质溶液为0.5mol/LNaOH溶液,电极为镁片和铝片,则负极的电极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示两套实验装置,分别回答下列问题。
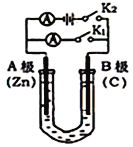
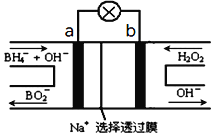
图1 图2
(1)如图1所示,U形管内盛有100mL的溶液,
①打开K2,闭合K1,若所盛溶液为CuSO4溶液:则B极的电极反应式为_______________________。
②打开K1,闭合K2,若所盛溶液为MgCl2溶液,则可观察到的现象是_________________________,总反应化学方程式是_________________________________。
③如要用电解方法精炼粗镍(元素符号Ni),打开K1,闭合K2,电解液选用NiSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Ni2+浓度_____(填“增大”、“减小”、“不变”)。
(2)图2装置为硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。
①电池的负极反应式为__________________________
②放电时,每转移2mol电子,理论上需要消耗_________g NaBH4
查看答案和解析>>
科目: 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾 (K2FeO4)是一种新型,高效的绿色水处理剂。工业上利用硫酸亚铁为原料,通过铁黄 (FeOOH)制备高铁酸钾,可降低生产成本产品质量优工艺流程如下:

化学兴趣小组的同学们在实验室中,通过KClO溶液与Fe(NO3)3溶液的反应模拟工业生产制备高铁酸钾,下图所示是模拟工业制备KClO溶液装置。

已知:K2FeO4可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解。
(1)工业流程中,需要加入试剂A制备铁黄(FeOOH),最合适的试剂A是:________。
A.Cl2 B.O2 C.KMnO4 D.HNO3
流程中制备铁黄涉及到的离子反应方程式:_______。
实验测得反应溶液的pH对铁黄产率的影响如下图所示,pH大于4.5时铁黄产率逐降低的主要原因可能是:______。

(2)根据工业流程推断,溶解度K2FeO4________ Na2FeO4 (填“>”或“<”)
(3)实验室使用KClO溶液和饱和Fe(NO3)3液制备高铁酸钾时,两种试剂的滴加顺序为________。
(4) K2FeO4在水溶液中易水解,在“提纯”K2FeO4中采用重结晶洗涤、低温烘干的方法,则洗涤剂最好选用____溶液(填序号)
a.水 b.NH4Cl、异丙醇 c. Fe(NO3)3、异丙醇 d.异丙醇
(5)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.00mol/l的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2= Na2S4O6+2NaI),淀粉作指示剂,三次滴定,消耗Na2S2O3标准溶液分别17.98、18.02、18.95mL。原样品中高铁酸钾的质量分数为________。[M(K2FeO4)=198g/mol]
查看答案和解析>>
科目: 来源: 题型:
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________.
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
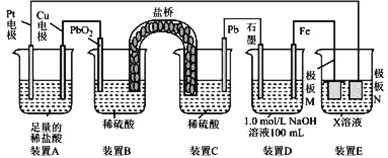
A.盐桥中的阳离子向装置B移动
B.装置A中总反应的离子方程式为 Cu+2H+ ![]() Cu2++H2 ↑
Cu2++H2 ↑
C.若在装置 D 中生成 0. 2 mol Fe(OH)3,则消耗水的物质的量共为0. 5mol
D.若装置E的目的是在Cu材料上镀银,则极板 N 的材料为Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸![]() 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。

Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸![]() 与甲醇
与甲醇![]() 的酯化反应实验:
的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度 | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是__________,长玻璃管c的作用是__________、__________
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为____________________。
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下,![]() 能与
能与![]() 固体发生反应:
固体发生反应:![]() 。
。
(1)如图所示是以甲酸钠![]() 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:

则a极电极反应式为_______________。
(2)测定产物中甲酸钠![]() 的纯度:
的纯度:![]() 与足量
与足量![]() 充分反应后,消耗标况下
充分反应后,消耗标况下![]() ,所得固体物质为
,所得固体物质为![]() ,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
(3)甲酸钠溶液呈弱碱性的原因:__________________(用离子方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】请按如图所示要求,完成下列实验:
实验①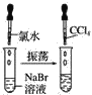
实验②
实验③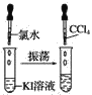
(1)实验①静置后,观察到实验现象是__,反应的化学方程式是__。
(2)实验②静置后,观察到实验现象是__,反应的化学方程式是__。
(3)实验③静置后,观察到实验现象是__,反应的化学方程式是__。
(4)通过上述实验可知,卤素单质氧化性由强到弱的顺序是__,卤素阴离子的还原性由强到弱的顺序是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
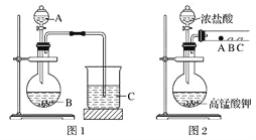
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com