
科目: 来源: 题型:
【题目】工业上用钛精矿(主要成分TiO2,矿粉中含有Fe,Al,Si,V等氧化物)制备海绵钛的基本思路是:氯化法生产TiCl4、还原、真空蒸馏法制备海绵钛(Ti)。
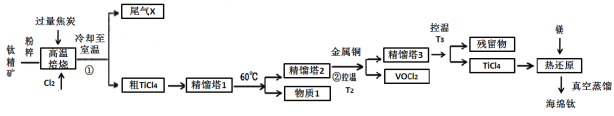
已知:①氯化过程中,其他元素均转化为最高价氯化物;
②热还原过程中,可能会有副产物TiCl3;
③常见物质熔沸点
化合物 | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
沸点 | 136 | 56 | 308 | 180(升华) | 134 | 168 | 1412 | 3260 | 1090 |
熔点 | -69 | -25 | 304 | 190 | -78.9 | —— | 712 | 1668 | 648.9 |
回答下列问题:
(1)将钛精矿粉粹的目的是:_______________
(2)氯化过程中,TiO2发生的化学方程式①是:_____________
(3)物质1是________,步骤②中金属铜的作用是将VOCl3还原成VOCl2,其目的是_____________;
(4)工业上常用Mg或H2作还原剂,在Ar气氛下采用热还原法制海绵钛。
①镁不足时,TiCl4会因有副产物产生而导致产率会下降,副反应的化学方程式为_____________;此处采用真空蒸馏法除去海绵钛中的Mg和MgCl2,不采用常压蒸馏的原因是_______。
②根据图象,计算1173K时,反应2H2+TiCl4 =Ti+4HCl的△G=_________。
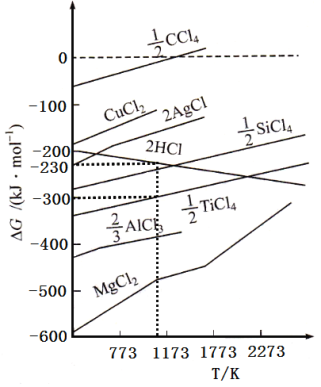
(G为自由能,图中△G是指在一定温度下,由单质生成对应物质的量化合物时的自由能变化。设此温度下,单质的生成自由能变化为0)
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化尿素(CO(NH2)2·H2O2)是过氧化氢水溶液与尿素的加和物,兼有尿素和过氧化氢的性质,是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。某化学小组同学用低浓度的双氧水和饱和尿素[CO(NH2)2]溶液在30℃条件下用右图装置合成过氧化尿素。请回答下列问题:
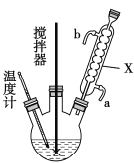
(1)仪器X的名称是______________;
(2)制备过氧化尿素的化学方程式为_______________________,反应时采取的受热方式为_____________;
(3)搅拌器不能选择铁质材料的原因是______________________
(4)过氧化尿素中活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品8.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL6mol·L-1H2SO4,然后用0.2000mol·L-1KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液与尿素不反应)。三次滴定平均消耗KMnO4溶液20.000mL:
①请完善滴定时反应的离子方程式:__MnO![]() +___H2O2+______==_______________
+___H2O2+______==_______________
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量_______(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量_______(填“合格”或“不合格”),活性氧的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
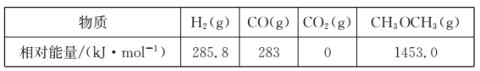
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
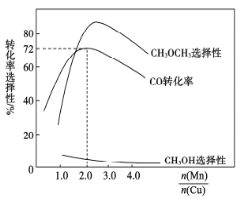
当n(Mn)/n(Cu)=2时,二甲醚的选择性(![]() )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
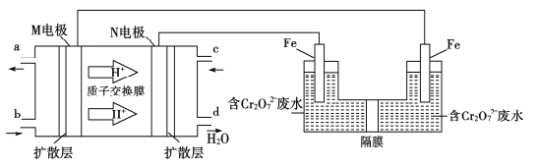
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s时测得C的浓度为0.6 mol·L-1,填写下列空白:
(1)用物质A表示反应的平均速率为_________。
(2)用物质B表示反应的平均速率为_________。
(3)2 s时物质A的转化率为_________。
(4)2 s时物质B的体积分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图实验。
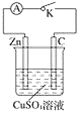
(1)打开K,观察到的现象为________________。
(2)关闭K,观察到的现象是_________。此电池的负极的电极反应式为_____。
(3)关闭K,溶液中阳离子向_______(填“Zn”或“C”)极移动,外电路中,电子流动方向是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
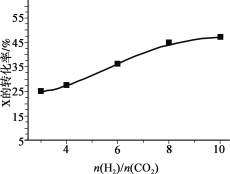
① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】试根据氧化还原反应:2FeCl3+Cu=2FeCl2+CuCl2设计原电池,并画出装置图________________,指出电解质溶液是________________,负极是________________,电极反应式为__________________,正极是___________,电极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
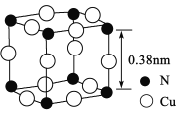
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知食盐常加入KIO3 来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)。
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为___L。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O![]() )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O![]() )]和-lgc(C2O
)]和-lgc(C2O![]() )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是
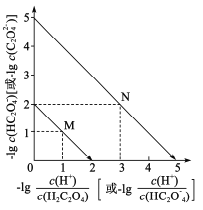
A.曲线M表示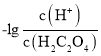 和
和![]() 的关系
的关系
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O![]() )>0
)>0
C.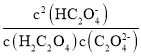 随pH的升高而减小
随pH的升高而减小
D.在NaHC2O4溶液中c(Na+)>(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(H2C2O4)
)>c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com