
科目: 来源: 题型:
【题目】近日,某科研团队成功合成了Ni—Fe双原子催化剂(Ni/Fe—C—N),并应用于高效催化CO2还原。回答下列问题:
(1)基态铁原子的价电子轨道排布图为__。铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+__Fe3+(填“>”或“<”),原因是__。
(2)C、N、O三种元素的第一电离能由大到小的顺序为__。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和为18,则n=___;该化合物易溶于苯及四氯化碳等有机溶剂,原因是___。
(4)二茂铁的结构为![]() ,由Fe2+和
,由Fe2+和![]() (环戊二烯基负离子)构成。一个
(环戊二烯基负离子)构成。一个![]() 中σ键总数为__,C原子的杂化轨道类型为__。
中σ键总数为__,C原子的杂化轨道类型为__。
(5)某C、Fe合金的晶胞结构如图所示:
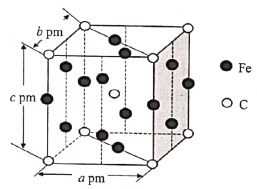
该合金的化学式为__,若该晶体的晶胞参数为apm、bpm、cpm,α=β=γ=90o,密度为ρg·cm-3,则NA为__(写出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.01mol/(L·s)B.v(B)=0.02mol/(L·s)
C.v(B)=0.60mol/(L·min)D.v(C)=1.00mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式___。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。请回答下列问题:
①用太阳能分解10mol水消耗的能量是___kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_____;
③研究NO2、SO2、CO等大气污染气体的处理具有重要意义,已知:
2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ/mol
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH=___kJ/mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是( )
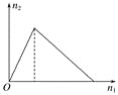
A.X为氢氧化钠,Y为氯化铝
B.X为氯化铝,Y为氢氧化钠
C.X为盐酸,Y为偏铝酸钠
D.X为偏铝酸钠,Y为盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】煤炭气化作为洁净煤利用的核心技术,是影响煤化工系统效率、污染物及温室气体排放的关键。工业生产中主要的气化方式包括纯水气化、CO2气化和纯氧气化,反应如下:
i.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+119kJ·mol-1
CO(g)+H2(g) ΔH=+119kJ·mol-1
ii.C(s)+CO2(g)![]() 2CO(g) ΔH=+162kJ·mol-1
2CO(g) ΔH=+162kJ·mol-1
iii.C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-123kJ·mol-1
CO(g) ΔH=-123kJ·mol-1
iv.C(s)+ O2(g)![]() CO2(g) ΔH=-409kJ·mol-1
CO2(g) ΔH=-409kJ·mol-1
(1)均相水煤气反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的ΔH__。
H2(g)+CO2(g)的ΔH__。
(2)图1是不同气化方式得到的合成气成分,图2是温度对碳转化率的影响(碳转化率是指气化得到气体中的碳占入炉原料煤中碳的质量分数)。
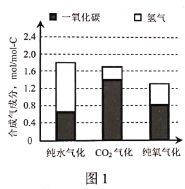
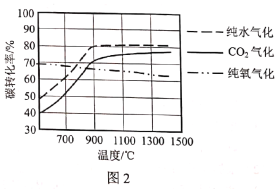
①气化过程中不同氧化剂的配比会对合成气的成分造成很大影响,为了提高合成气的氢碳比,生产中应该适当提高__在氧化剂中的比例。
②若使用混合氧化剂进行气化,最佳气化温度是___℃。温度升高纯氧气化的碳转化率降低,原因是___。
③工业上常在压强200kPa的条件下进行气化,压强过高过低都不利于气化的进行,可能的原因是__。
④T℃时,向容积可变的恒压密闭容器中加入20g燃煤(含碳84%)和2molH2O(g)模拟纯水气化反应,起始容积为2L。一段时间达到平衡后,测得容器内H2为1mol。则该温度下C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数K=__。
CO(g)+H2(g)的平衡常数K=__。
(3)煤的气化中可以利用CO2捕集技术实现CO2的综合利用。用石墨电极电解CO2制CH3CH2OH的原理示意图如图:
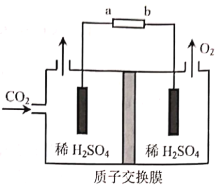
①b为电源的___(填“正”或“负”)极。
②生成CH3CH2OH的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
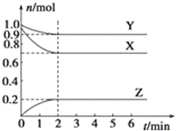
(1)该反应的化学方程式为:____。
(2)反应开始至2min,用X表示的平均反应速率为_____。
(3)反应开始至2min时,Y的转化率为___。
(4)对于上述反应当改变下列条件时,反应速率会发生什么变化(填“增大”、“减小” 或“不变”)?
①降低温度:_____;
②保持容器的体积不变,增加X的物质的量:____;
③保持容器的体积不变,增加He:____;
④增大容器的体积:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,在100mL0.1mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化和H2S的挥发)。下列说法正确的是( )
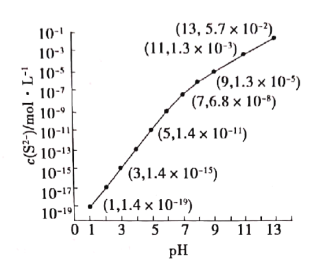
A.当c(H2S)+c(HS-)=0.043mol·L-1时,pH=13
B.pH=1时,c(H+)=c(Cl-)+c(HS-)+ c(S2-)+c(OH-)
C.向该溶液中加入NaOH固体至中性时c(Na+)>c(HS-)>c(S2-)>c(H+)=c(OH-)
D.已知:Ksp(MnS)=2.8×10-13,某溶液含amol·L-1Mn2+、0.10mol·L-1H2S,当溶液pH=5时,Mn2+开始沉淀,则a=0.2
查看答案和解析>>
科目: 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】天津大学某科研团队创新地提出了一种基于电化学冶金原理并利用电解质去耦合策略,在电池中同时进行MnO2和Zn可逆溶解/电沉积的储能机制,其工作原理如图,电池放电总反应为Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O。下列说法不正确的是( )
+Mn2++2H2O。下列说法不正确的是( )
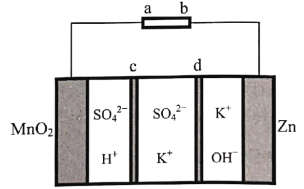
A.充电时,Zn电极区为阴极区
B.c为阴离子交换膜,d为阳离子交换膜
C.放电时,正极电极反应式为MnO2+4H++2e-=+Mn2++2H2O
D.充电时,电子的流向为a→MnO2→电解质溶液→Zn→b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com